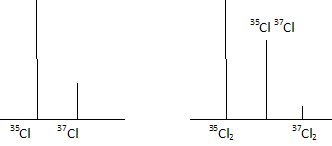|
Calcul de pH, thermochimie, atomistique chimie concours technicien police scientifique 09.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(A) CH3-CHOH-COONa ; (B) CH3-CHOH-COOH ; (C) HCl Quel est le pH de la solution (A) . Justifier les approximations ? On note AH, l'acide lactique et A- sa base conjuguée. Réaction prépondérante : A- + H2O = AH + HO- ; K = [AH][HO-] / [A-] K = [HO-] [H3O+][AH] / ([A-][H3O+]) =10-14 / 10-3,86 =10-10,14 =7,2 10-11 , K est faible, réaction très limitée.
x = (7,2 10-11 * 0,1 )½ =2,7 10-6 mol/L ; [ H3O+] = 10-14 / (2,7 10-6)=3,7 10-9 mol/L ; pH = 8,4. L'hypothèse x<<0,1 est bien vérifiée. Quel est le pH des solutions obtenues en mélangeant : - un litre de (A) avec un litre de (B) : on obtient une solution tampon telle que [AH]=[A-] ; pH= pKa = 3,86. - un litre de (A) avec un litre de (C) : Réaction prépondérante : A- + H3O+ = AH + H2O ; K = [AH]] / ([A-] [ H3O+]) = 1/10-3,86 = 103,86, valeur grande réaction totale. A l'équivalence on obtient une solution d'acide lactique de concentration 0,05 mol/L, la réaction prépondérante est alors : AH + H2O = A- + H3O+ ; K = 10-3,86=1,4 10-4 valeur faible réaction très limitée. x = (1,4 10-4 * 0,05
)½ =2,6 10-3 mol/L
; pH = 2,6. L'hypothèse x<<0,05 est bien
vérifiée. Réaction prépondérante : A- + H3O+ = AH + H2O ; K = [AH]] / ([A-] [ H3O+]) = 1/10-3,86 = 103,86, valeur grande réaction totale.
Donnez les trois équilibre de dissociation dans l'eau de l'acide phosphorique H3PO4. Expliquer qualitativement la variation de la valeur des pKa. On donne : pKa1 = 2,15 ; pKa2 = 7,2 ; pKa3 = 12,3. H3PO4 + H2O = H2PO4- + H3O+. H2PO4- + H2O = HPO42- + H3O+. HPO42- + H2O = PO43- + H3O+. couple acide base H3PO4 / H2PO4- : pKa1 = 2,15 ; couple acide base H2PO4- / HPO42- : pKa1 = 7,2 ; A concentration égale, H3PO4 est un acide plus fort que H2PO4-. couple acide base H2PO4- / HPO42- : pKa1 = 2,15 ; couple acide base HPO42- / PO43- : pKa1 = 12,3 ; A concentration égale, H2PO4- est un acide plus fort que HPO42-.
Thermochimie. La combustion à pression constante et sous 1 atmosphère ( 101325 Pa) d'une quantité à déterminer d'éthanol liquide en présence de 22,4 L de dioxygène dégage 342,76 kJ à 298 K. Ecrire l'équation de combustion de l'éthanol. C2H5OH (l) + 3O2(g) = 2CO2(g) + 3H2O(l) (1). Calculer la quantité de matière (mol) déthanol sachant quil reste 5,6 L de dioxygène non utilisé. Volume molaire des gaz : Vm = 8,31 *298 / 101325 = 24,44 L /mol. Volume de dioxygène utilisé lors de la combustion : V = 22,4-5,6 = 16,2 L Quantité de matière de dioxygène n = V/Vm = 16,2 / 24,4 = 0,663 mol D'après les coefficients stoechiométriques de (1), la quantité de matière d'alcool vaut : 0,663 / 3 = 0,221 mol. Calculer la variation d'enthalpie molaire de combustion de l'éthanol. -342,76 / 0,221 = -1,55 103 KJ mol-1. Calculer la variation d'enthalpie de la réaction suivante à 298 K. C2H5OH(l) + O2(g) = C2H4O2(l) + H2O(l). (3) On donne l'enthalpie molaire de combustion de l'acide acétique à 298 K : -873,62 kJ /mol. C2H4O2 (l) + 2O2(g) = 2CO2(g) + 2H2O(l) (2). [ -873,62 kJ /mol.] (1) -(2) donne (3) d'où : -1,55 103 + 873,62 = -677,4 kJ /mol.
Atomistique. Le chlore naturel ( Cl : 35,453 g/mol) est constitué de deux isotopes 35Cl ( 34,969 g/mol) et 37Cl ( 36,947 g/mol). Déterminer les abondances isotopiques de 35Cl et 37Cl. On note x l'abondance isotopique de 35Cl : 34,969 x + 36,947 (1-x) = 35,453 d'où x = 0,755. On s'intéresse aux molécules de dichlore Cl2. On considère que les atomes 35Cl et 37Cl tous liés ( en molécule diatomique) le sont indistinctement. On définit la fraction molaire de l'entité A dans le mélange par la relation x(A) = n(A) / Sni : nombre total de mole. Démontrer la relation x(35Cl)- x(37Cl) = x(35Cl2)- x(37Cl2) atome : Sni = n(35Cl) + n(37Cl) ; x(35Cl) =n(35Cl) /( n(35Cl) + n(37Cl)) = 0,755 ; x(37Cl) =n(37Cl) /( n(35Cl) + n(37Cl)) = 0,245 x(35Cl)- x(37Cl) =0,755-0,245 = 0,51. molécule : x(35Cl2)= x(35Cl) * x(35Cl) ; x(37Cl2) =(37Cl * 37Cl ) ; x(35Cl2)- x(37Cl2) = [ x(35Cl) - x(37Cl)][ x(35Cl) + x(37Cl)] = x(35Cl) - x(37Cl) =0,755-0,245 = 0,51. Exprimer x(35Cl2), x(37Cl2), x(35Cl37Cl) en fonction de x(35Cl) et x(37Cl). Calculer les fractions molaires. x(35Cl2) =x(35Cl) * x(35Cl) = 0,7552 =0,570 ; x(37Cl2) =x(37Cl) * x(37Cl) = 0,2452 =0,060 ; x(35Cl37Cl) =2 x(35Cl)*x(37Cl) =2* 0,755 *0,245 = 0,370. Calculer de deux manières différentes la masse molaire du dichlore. M = 2*35,453 =70,906 g/mol. M = 0,570*34,969*2 + 0,06*36,947 *2 + 0,370*(34,969+36,947) =70,907 g/mol. Représenter de façon approchée l'allure du spectre de masse ( abondance des particules en fonction de leur masse ) du chlore atomique et du dichlore moléculaire.
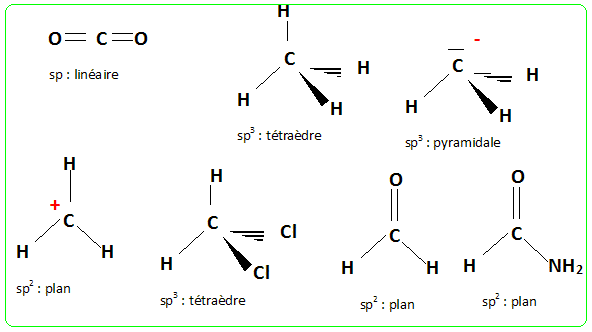
Décrire et justifier la structure des espèces chimiques suivantes : CO2, CH4, H2CO, CH3-, CH3+, CH2Cl2, HCONH2. La forme des édifices covalents (molécules ou ions) est déterminée par la répulsion existant entre les doublets électroniques de la couche de externe de l'atome central. Les doublets liants ou non liants se placent le plus loin possible les uns des autres. Une liaison double, une liaison triple sont comptées pour un unique volume électronique.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|