|
QCM : oxydo-réduction, chimie organique : concours kiné Poitiers 1999.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Cu2+ / Cu : +0,34 V ; Fe2+ / Fe : -0,44 V ; Zn2+ / Zn : -0,76 V ; Sn2+ / Snu : -0,14 V ; Mg2+ / Mg : -2,37 V. Pour protéger les coques des navires de la corrosion on fixe sur la coque en fer des blocs métalliques appelés anodes sacrifiées, qui sont oxydées à la place de la coque et qui doivent être régulièrement renouvelées. Pour fabriquer ces anodes onpeut utiliser : du cuivre, du zinc, du magnésium, du fer, de l'étain. Un métal est d'autant plus réducteur que son potentiel standard est plus négatif. Le zinc et le magnésium, plus réducteurs que le fer peuvent être utilisés.
Un faraday = 96500 C ; M(Pb) = 207,2 g/mol. Une batterie d'accumulateurs pour automobile a une capacité de 100 Ah et une force électromotrice E=12 V. Elle est constituée de 6 éléments montés en série. Au cours d'une décharge la plaque négative de plomb est oxydée : Pb (s) + SO42- = PbSO4 (s) + 2e-. La variation de masse de la plaque négative d'un accumulateur pendant une décharge totale est : -0,773 kg ; -386,5 g ; +386,5 g ; +0,773 kg ; -64,4 g. Le plomb métal s'oxyde : sa masse diminue. Quantité d'électricité : 100 Ah = 100*3600 = 3,6 105 C. Quantité de matière d'électrons : n(e-) = 3,6 105 /96500 =3,73 mol Quantité de matière de plomb : n(Pb) = ½n(e-) =0,5*3,73 =1,865 mol Masse de plomb correspondante m = n(Pb) M(Pb) = 1,865*207,2 =386,5 g La masse de plomb diminue de 386,5 g ; réponse - 386,5 g.
On fait barboter 1 m3 d'air pollué dans l'eau. Le dioxyde de soufre présent dans l'air se dissout entièrement. La solurion aqueuse obtenue est dosée par une solution de permanganate de potassium à 10-4 mol/L et en milieu acide ( sulfurique). Il faut verser 4,7 mL pour atteindre l'équivalence Equation du dosage :2 2MnO4- + 5 SO2 aq + 2H2O = 5 SO42- + 2Mn2+ + 4H+aq. La teneur en dioxyde de soufre dans l'air étudié est donc : 0,190 mmol/L ; 1,175 mmol/L ; 1,175 µmol m-3 ; 0,190 µmol m-3 ;1,175 nmol /L. Quantité de matière d'ion permanganate à l'équivalence : 4,7 * 10-4 mmol. On note n la quantité de
matière initiale de SO2 dans 1
m3 d'air. 4,7 * 10-4 -2xfin = 0 ; xfin =4,7 * 10-4 / 2 = 2,35 10-4 mmol. n-5xfin =0 ; n = 5 xfin = 5*2,35 10-4 =1,175 10-3 mmol dans 1 m3. 1,175 10-3 mmol m-3 = 1,175 10-6 mol m-3 =1,175 µmol m-3 = 1,175 10-6 mmol L-1 = 1,175 nmol L-1.
Le mélange initial contieny 2 mol d'acide et 1 mol d'éthanol. A l'équilibre il s'est formé 0,845 mol d'ester. Combien reste t-il de moles d'acide à l'équilibre ? 1,255 ; 1,005 ; 1,000 ; 1,115 ; 0,155.
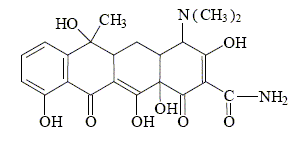
Dans la molécule de tétracycline ( antibiotique), de formule :
il y a : 3 fonctions cétone; 1 fonction amide ; 1 fonction acide carboxylique ; 5 fonctions alcool ; 2 fonctions cétone.
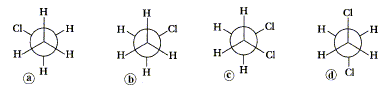
La réaction de saponification est : -totale et lente (Vrai) - limitée et rapide. Dans l'ion carboxylate d'un savon, le groupe carboxylate est : - hydrophile (Vrai) ; lipophile ; hydrophobe. Soient les 4 molécules suivantes :
- a et b sont des isomères de configuration - a et b sont des conformères ( Vrai) - a et b sont deux énantiomères - c est appelé conformère décalé droite - d est appelé conformère décalé anti (Vrai)
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|