|
Produit de solubilité du chlorure d'argent : pile ; énergie réticulaire concours Mines 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||
| .
. |
||||||||
|
||||||||
|
Dans un bécher n°1, on verse environ 40 mL d’une solution de chlorure de potassium ( K+ ; Cl-) de concentration CA = 1,00.10-2 mol.L-1 ; après addition d’une goutte de nitrate d’argent (Ag+ + NO3-) de concentration CB = 1,00.10-2 mol.L-1 , on observe la formation d’un précipité de chlorure d’argent AgCl(s). Dans un bécher n°2, on verse environ 50 mL de nitrate d’argent de concentration CB = 1,00.10-2 mol.L-1 . On plonge une lame d’argent dans chacun des béchers que l’on relie par un pont salin au nitrate d’ammonium (NH4++ NO3-). On mesure alors à 27°C la force électromotrice de la pile ainsi constituée : E =E2-E1 = 0,36 V où E1 et E2 représentent les potentiels des lames d’argent plongeant respectivement dans les béchers 1 et 2. On posera c° = 1,00 mol/L et e°=RT/F ln10. Données à 27°C : e° = 0,060 V ; E°1= 0,80 V ; Ks(AgBr)= 7,7.10-13. Réaliser un schéma légendé de la pile, en spécifiant les branchements du voltmètre (bornes COM et mV). 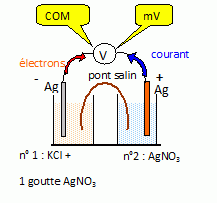 E2 étant supérieure à E1, l'électrode du bécher n°2 constitue la borne positive de la pile. Préciser le rôle du pont salin ; expliquer pourquoi on ne peut pas utiliser un pont au bromure de potassium (K+ + Br-). Le pont salin permet la continuité électrique et assure l'électroneutralité des solutions lors du fonctionnement de la pile. Les ions Br- donnant un précipité de bromure d'argent ( Ks (AgBr) étant inférieur à Ks(AgCl), le solide AgBr apparaît avant AgCl ), en présence d'ion argent, on ne peut pas utiliser du bromure de potassium.
E1 = E°1 +0,06 log [Ag+]1 avec Ks =[Ag+]1 [Cl-]1 = [Ag+]1 CA. Exprimer puis calculer le potentiel standard E°2 du couple AgCl/Ag. Expliquer qualitativement pourquoi sa valeur est inférieure à celle du couple Ag+ /Ag.
Energie réticulaire du chlorure d'argent. L’énergie réticulaire d’un cristal ionique est l’énergie interne standard de réaction à 0 K, DrU° associée à la dissociation du cristal en ses ions constitutifs, isolés et à l’état gazeux. On la confondra ici avec l’enthalpie standard DrH° associée à cette même réaction à 298 K. Ecrire, en précisant l’état physique de chaque constituant, les équations de réaction permettant de définir : • l’enthalpie standard de formation du chlorure d’argent solide à 298 K : Ag(s) + ½Cl2(g) = AgCl(s), DHf = -127 kJ/mol • l’énergie d’ionisation de l’argent : l'argent métallique solide est transformé en argent gazeux, l'énergie nécessaire pour cette transformation correspond à l'énergie de sublimation DHsubl =285 kJ/mol. L'argent gazeux atomique est ionisé en ion Ag+(g) , l'énergie nécessaire est l'énergie d'ionisation DEI = 727 kJ/mol. Ag (g) = Ag+(g) + e-. • l’énergie d’attachement électronique du chlore. Le dichlore gazeux est dissocié en deux atomes de chlore gazeux, l'énergie nécessaire est l'énergie de dissociation DHD = 242 kJ/mol. Le chlore gazeux atomique reçoit 1 électron et devient Cl-(g) , l'énergie nécessaire est l'énergie d'attachement électronique DAE = -350 kJ/mol. Cl(g) + e- = Cl-(g). On rappelle que le dichlore est à l’état gazeux dans son état standard de référence à 298 K. Déterminer l’énergie réticulaire Eret du chlorure d’argent. On pourra s’aider d’un cycle thermodynamique et on négligera l’influence de la température. 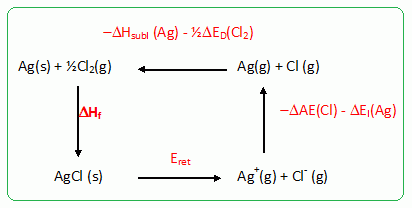 Eret = DHf - DHsubl -½DHD -DAE-DEI ; Eret = -127 -285 -0,5*242 -(-350) -727 = -910 kJ mol-1.
|
||||||||
| |
||||||||
|
|