|
Composition d'un laiton ; corrosion et anticorrosion des métaux concours général 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
Afin de remplacer une pièce en laiton trop endommagée, on cherche à déterminer les proportions respectives du cuivre et du zinc de cette pièce. La création d'un laiton respectant les proportions exactes de la pièce abimée permettra de reproduire une coloration identique à celle créée à l'origine. On pèse 150 mg de laiton provenant d'une pièce de boulonnerie du pont, que l'on place dans 10 mL d'une solution aqueuse d'acide nitrique ( c = 18 mol/L) fumant. L'acide nitrique attaque le laiton. Le technicien ajoute alors 350 mL d'eau et quelques gouttes d'une solution aqueuse d'acide sulfurique concentrée. La solution ionique obtenue est électrolysée entre deux électrodes de platine. L'intensité est maintenue constante pendant la durée Dt = 6,0 min de l'opération à la valeur de I = 1,0 A. L'élément cuivre est recupéré sous forme de cuivre métallique sur la cathode dont on peut mesurer la masse. Afin d'être sur que l'électrolyse est arrivée à son terme et qu'il n'y a plus d'ions Cu2+(aq) en solution, on ajoute un exceès d'ammoniaque NH3 (aq) dans le milieu électrolysé, de telle sorte que la concentration en ammoniaque dans le milieu soit de 0,5 mol/L . En présence de traces d'ions cuivre (II), il se forme un complexe caracteristique, de couleur " bleu celeste ", selon l'équation chimique : Cu2+(aq) + 4NH3(aq) = [Cu(NH3)4]2+ (aq) ; K1 = 2,0 1012. Quanité d'électricité Q = I
Dt =1,0*6,0*60 = 360
C. Quantité de matière
d'électrons Q = n(e-)*96500 ;
n(e-) = 360/96500 =3,73 10-3
mol Or Cu2+(aq) + 2e- =
Cu(s) Quantité de matière de cuivre
n(Cu) = ½n(e-) =3,73
10-3 /2 =1,865 10-3
~1,9 10-3
mol. En déduire la
masse de cuivre attendue ? M(Cu) = 63,5
g/mol. m = n M =1,865 10-3*63,5 = 0,1184
~0,12
g. Cuivre : masse de cuivre / masse totale *100 = 0,1184 /150*100 =78,96 ~79 % ; 21 % de zinc. On supposera dans cette question que ce laiton n’est constitué que de cuivre et de zinc. Ecrire l’équation de la réaction d’oxydoréduction entre le cuivre Cu(s) et les ions nitrate de la solution d’acide nitrique NO3-(aq). Oxydation du cuivre : 3 fois{ Cu(s) = Cu2+(aq) + 2e-} ; Réduction des ions nitrates : 2 fois{ NO3-(aq) + 3e- + 4H+(aq) = NO(g) + 2H2O (liq)} 2NO3-(aq) + 3Cu(s) + 8H+(aq) = 2NO(g) + 4H2O (liq) +3Cu2+(aq). La constante d’équilibre K2 de cette réaction vaut 4,64.1036 . Calculer le quotient de réaction initial Qr,i et déterminer le sens d’évolution spontané du système. Qr,i = [Cu2+(aq)]3i / ([H+(aq)]i8[NO3-(aq)]i2) = 0 car [Cu2+(aq)]3i est nulle. Qr,i < K, donc évolution spontanée dans le sens direct. Au cours de la manipulation, on voit apparaître au dessus de la solution un gaz roux caractéristique : le dioxyde d’azote NO2 (g). Comment expliquer sa présence ? Oxydation de NO(g) en présence du dioxygène de l'air. Ecrire l’équation de la réaction susceptible d’avoir lieu lors de l’ajout d’ammoniaque dans le milieu électrolysé. Réaction acide base entre l'ammoniac et l'acide nitrique en excès et de l'acide sulfurique. H3O+(aq) + NH3(aq) = NH4+(aq) +H2O(liq) Pour que la coloration bleue soit visible, il faut que la concentration en complexe [Cu(NH3)4]2+ soit supérieure ou égale à 1,0.10-5 mol/L. Quelle concentration minimale en ions Cu2+(aq) cette méthode permet-elle de détecter dans notre cas ? Conclure quant à la précision des résultats. Cu2+(aq) + 4NH3(aq) = [Cu(NH3)4]2+ (aq) ; K1 = 2,0 1012. K1 = [[Cu(NH3)4]2+ ]/ ([NH3(aq)]4[Cu2+(aq)]) avec [NH3(aq)] pratiquement constant ( large excès). [Cu2+(aq)] = [[Cu(NH3)4]2+ ] / ([NH3(aq)]4 K1)= 1,0.10-5 / (0,54 * 2,0 1012)=8,0 10-17 mol/L. Cette valeur est très faible ; la méthode est très précise.
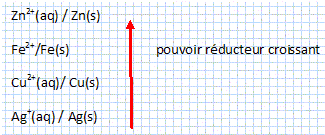
Le phénomène de corrosion peut être défini par la dégradation de l'état métallique initial pouvant aller jusqu'à sa destruction sous l'action du milieu ambiant et par un processus autre que mécanique. L'étude de la corrosion a débuté aux environs du 17e siècle, mais ce n'est qu'au cours du 19e siècle que l'on a étudié scientifiquement les moyens de lutter contre cette corrosion. Les facteurs de corrosion ont diverses origines : physiques, dues à l'érosion du vent, au sable, ourésultats de chocs ... ; chimiques, liées à des produits chimiques, dus à la présence d'oxygène en atmosphère sèche à haute température ; biologiques, les altérations étant liées au développement de micro-organismes (bactéries, champignons, algues ...) ; électrochimiques, la corrosion se développe alors en présence d'un électrolyte composé par exemple d’eau, de sels et d’oxygène. Dans les ouvrages d’art, la majorité des altérations des métaux est liée à l'action électrochimique ayant lieu dans des couches minces d'électrolyte, constituées d'eau atmosphérique plus ou moins polluée avec des concentrations en oxygène plus ou moins variées. Cette corrosion est susceptible d'entraîner un autre type de corrosion : la corrosion galvanique. Mis au contact d’une solution ionique (eau de pluie ou de mer), deux métaux forment une pile. A l’anode de la pile, l’un des métaux s’oxyde. Celui qui constitue la cathode est protégé del’oxydation par le milieu ambiant et demeure inaltéré, tant que l’autre métal n’est pas entièrement consommé. L'anticorrosion c'est la mise en place de toutes les actions qui tendront à ralentir, à annihiler la corrosion des matériaux métalliques afin de les conserver. Dans le cas des ouvrages d’art, il est bien souvent impossible d'éliminer la ou les causes de corrosion. Anéantir leur interaction, le plus souvent par des actions d'isolation du support métallique vis-à-vis de son environnement, par revêtements métalliques, et/ou organiques reste une des seules possibilités. Sur les ferreux, avant toute protection anticorrosion, la préparation de surface du métal est essentielle. En effet, le meilleur des traitements appliqués sur une surface mal décapée, mal nettoyée, n'aura qu'une durabilité très limitée. : tout ce qui peut être néfaste à la protection appliquée ultérieurement doit être éliminé, soit manuellement (brossage, nettoyage à la flamme...), soit par projection d'abrasifs. D'autres techniques existent, telles que la projection d'eau, le traitement laser, l'utilisation de procédés chimiques. La protection anticorrosion par revêtement peut être de différents types : - revêtement métallique (métal) - revêtement organique (peintures) - revêtement mixte (métal + peintures). Afin de préparer une protection anticorrosion par revêtement métallique, on cherche à classer, parordre de pouvoir réducteur croissant, les éléments suivants : cuivre, argent, zinc, fer.
Il s’agit donc de déterminer parmi les réducteurs des couples suivants celui qui est le plus efficace, c’est-à-dire qui réduit le plus possible d’espèces chimiques : Cu2+(aq)/Cu(s) ; Ag+ (aq) / Ag(s) ; Zn2+(aq)/Zn(s) ; Fe2+(aq)/Fe(s). Pour réaliser ce classement, on effectue les mesures de force électromotrice des piles suivantes : Fe(s) / Fe2+(aq) // Ag+(aq) / Ag(s) ; E > 0 Fe(s) / Fe2+(aq) //Cu2+(aq) /Cu(s) ; E > 0 Zn(s)/Zn2+(aq)//Fe2+(aq)/Fe(s) ; E > 0 Cu(s) /Cu2+(aq) // Ag+(aq) / Ag(s) ; E > 0 Rappeler la définition d’une anode et d’une cathode. anode : électrode où se produit une oxydation ; cathode : électrode où se produit une réduction. Pour chacune des piles réalisées, déterminer l’anode et la cathode. En déduire les réactions d’électrode, puis l’équation de la réaction de chaque pile. Dans une pile l'anode est négative : un réducteur s'oxyde et libère des électrons. Fe(s) / Fe2+(aq) // Ag+(aq) / Ag(s) ; E > 0 anode : Fe(s)= Fe2+(aq) + 2e- ; cathode : 2Ag+(aq) + 2e- = 2Ag(s). Fe(s) + 2Ag+(aq) = Fe2+(aq) + 2Ag(s). Fe(s) / Fe2+(aq) //Cu2+(aq) /Cu(s) ; E > 0 anode : Fe(s)= Fe2+(aq) + 2e- ; cathode : Cu2+(aq) + 2e- = Cu(s). Fe(s) + Cu2+(aq) = Fe2+(aq) + Cu(s). Zn(s)/Zn2+(aq)//Fe2+(aq)/Fe(s) ; E > 0 anode : Zn(s)= Zn2+(aq) + 2e- ; cathode : Fe2+(aq) + 2e- = Fe(s). Zn(s) +Fe2+(aq) = Zn2+(aq) + Fe(s). Cu(s) /Cu2+(aq) // Ag+(aq) / Ag(s) ; E > 0 anode : Cu(s)= Cu2+(aq) + 2e- ; cathode : 2Ag+(aq) + 2e- = 2Ag(s). Cu(s) + 2Ag+(aq) = Cu2+(aq) + 2Ag(s). Indiquer ce qui se passe si l’on place une lame de fer dans une solution aqueuse contenant des ions Cu2+(aq). Quel élément est le plus réducteur : le fer ou le cuivre ? Le fer, plus réducteur que le cuivre, s'oxyde ; les ions Cu2+(aq) se réduisent en Cu(s) ; ce dernier se dépose sur le fer. Même question dans le cas d’une lame de zinc plongeant dans une solution aqueuse contenant des ions Fe2+(aq). Quel élément est le plus réducteur, le fer ou le zinc ? Le zinc, plus réducteur que le fer, s'oxyde ; les ions Fe2+(aq) se réduisent en Fe(s) ; ce dernier se dépose sur le zinc. Même question dans le cas d’une lame de fer plongeant dans une solution aqueuse contenant des ions Ag+ (aq) . Quel élément est le plus réducteur, le fer ou l’argent ? Le fer, plus réducteur que l'argent, s'oxyde ; les ions Ag+(aq) se réduisent en Ag(s) ; ce dernier se dépose sur le fer.
|
|||||||
|
c |
|||||||
|
|