|
acide base: critère d'évolution, taux d'avancement final concours Fesic 2008
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
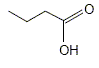
A- Il s’agit de l’acide propanoïque. Faux. La formule topologique correspond à : CH3-CH2-CH2-COOH, acide butanoïque L'acide propanoïque compte seulement 3 atomes de carbone. B- La masse molaire moléculaire de la molécule représentée est égale à 89 g.mol-1. Faux. M(C4H8O2) = 4*12+8+2*16 = 88 g/mol. C- La réaction entre cet acide et l’eau est limitée. Vrai. D- Le taux d’avancement final de la réaction est d’environ 1,7 %. Vrai. Le tableau suivant est établi pour un volume V = 1 L.
taux d'avancement final :
On dispose de quatre solutions de même concentration molaire en soluté apporté c = 1,0.10–2 mol.L–1. Elles contiennent respectivement de l’acide éthanoïque H3C–CO2H(aq), de l’éthanoate de sodium (Na+ (aq) + H3C–CO2-(aq)), de l’acide méthanoïque H–CO2H(aq) et du méthanoate de sodium (Na+ (aq) + H–CO2-(aq)). On réalise deux solutions, S1 et S2, en mélangeant les volumes suivants, exprimés en mL, des quatre solutions précédentes :
On considère la réaction d’équation : H3C–CO2H(aq) + H–CO2-(aq) = H–CO2H(aq) + H3C–CO2-(aq). pKa des couples
acide / base :
H–CO2H(aq)
/ H–CO2-(aq) :
pKa1 =
3,8. H3C–CO2H(aq)
/
H3C–CO2-(aq)
: pKa2 =
4,8. A-
La constante
d’équilibre de cette réaction
s’écrit
:
C- Dans la solution S1, la réaction a lieu dans le sens direct. Faux.
D- Dans la solution S2, la réaction a lieu dans le sens inverse. Faux.
On réalise un mélange à partir d’un volume V1 = 10 mL d’une solution aqueuse de chlorure de magnésium (Mg2+(aq) + 2 Cl-(aq)) de concentration molaire en soluté apporté c1 = 0,10 mol.L-1 et d’un volume V2 = 10 mL de solution aqueuse de carbonate de sodium (2 Na+(aq) + CO32-(aq)) de concentration molaire en soluté apporté c2 = 0,10 mol.L-1. On donne l’équation de la réaction modélisant la précipitation du carbonate de magnésium dans l’eau. Mg2+(aq) + CO32-(aq) = MgCO3(s). La constante de cette réaction est K =1,0 105. On donne 10½ = 3,2. A- L’expression du quotient de la réaction est Qr = [Mg2+(aq)] [CO32-(aq)]. Faux.
B- Le quotient initial de la réaction de dissolution Qr,i a une valeur égale à 2,5.10-3. Faux. [Mg2+(aq)]i = c1V1 /(V1+V2)= ½ c1 = 0,050 mol/L ; [CO32-(aq)]i = ½ c2 = 0,050 mol/L.
C- On observe une précipitation du carbonate de magnésium. Vrai. Qr i <K, évolution spontanée en sens direct. D- La concentration molaire en ions carbonate à l’équilibre [CO32-(aq)]éq est égale à 0,050 mol.L-1. Faux. [CO32-(aq)]éq = [Mg2+(aq)]éq = K-½ =(105)-½ = 10-2 * 10-½ =10-2 /3,2 ~ 3 10-3 mol/L.
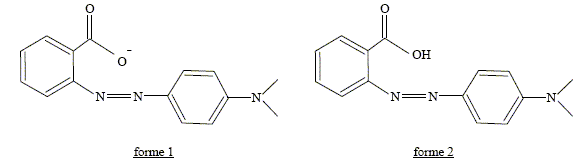
C15H14O2N3 : M = 15*12+14+2*16+3*14 =268 g/mol. B- Lorsque la forme 2 est prépondérante, la solution a une teinte jaune. Faux. La forme 2 est la forme acide ( R-COOH) du couple acide / base R-COOH / R-COO- : celle-ci prédomine à pH inférieur à pKa ( pH <5,2). La solution a une teinte rouge en milieu très acide. C- L’absorbance de la forme 1 est nulle dans le jaune. Faux. La forme 1 est la forme basique : sa teinte est jaune. Elle absorbe la couleur complémentaire du jaune, c'est à dire le bleu.
L'absorbance est nulle dans le jaune ; l'absorbance est maximale dans le bleu. D-
A pH= 4,2 :
Produit ionique de l'eau :[H3O+][HO-]=10-pKe. L'eau pure est électriquement neutre : [H3O+]= [HO-]=10-½pKe = 10-7,3. B- A 60°C une solution de pH égal à 6,8 est basique. Vrai. Le pH du milieu neutre est 13/2 = 6,5. Une solution dont le pH est supérieur à 6,5 est basique à 60°C. On dispose de trois solutions aqueuses S1, S2, S3, de même concentration molaire en soluté apporté, respectivement d’acide benzoïque C6H5COOH(aq), d’acide nitreux HNO2(aq), et de chlorure d’ammonium NH4+(aq) + Cl-(aq). Données : A 25 °C : C6H5COOH(aq) /C6H5COO-(aq) : pKa1 = 4,2. HNO2(aq) /NO2-(aq) : pKa2 = 3,3. NH4+(aq) /NH3 : pKa3 = 9,2. C- L’avancement final de la réaction de l’acide nitreux avec l’eau est plus grand que celui de la réaction de l’acide benzoïque avec l’eau. Vrai. A concentration égale, l'acide le plus fort possède le plus petit pKa. Plus l'acide est fort, plus l'avancement final est proche de l'avancement maximal. On considère une solution aqueuse de chlorure d’ammonium, de concentration molaire en soluté apporté c = 5,0 .10-3 mol/L. D- Le taux d'avancement final de la reaction t de cet acide avec l'eau est égal à 0,20. Faux. pH =½( pKa - log c) = 0,5 (9,2 - log 5,0 .10-3 ) = 5,75. Pour 1 L de solution : avancement final xfin = 10-pH = 10-5,75 = 1,8 10-6 mol ; xmax =5,0 .10-3 mol taux d'avancement final :
Données : 0,020 = 10 –1,7 ; volume molaire dans les conditions de l’expérience Vm = 24 L.mol-1. A- La concentration molaire de la solution aqueuse S est égale à 20 mmol/L. Vrai. Quantité de matière HCl(g) : n =V / Vm = 0,24 / 24 = 0,010 mol= 10 mmol. Concentration (mmol/L) = n(mmol) / volume de la solution (L) =10/0,5 = 20 mmol/L. On mesure le pH de la solution S, on trouve 1,7. B- Le chlorure d’hydrogène n’est pas totalement dissocié dans l’eau. Faux. Le chlorure d'hydrogène réagi totalement avec l'eau et donne une solution d'acide chlorhydrique, acide fort. On obtient une solution S’ en mélangeant 20 mL d’une solution d’acide chlorhydrique de concentration molaire en soluté apporté 1,0.10-1 mol.L-1 et 20 mL d’une solution aqueuse d’hydroxyde de sodium de concentration molaire en soluté apporté 5,0.10-2 mol.L-1. C- Le pH du mélange est égal à 3. Faux. couple acide / base : H3O+ / H2O et H2O / HO-.
Si l'hydroxyde de sodium est en excès : 1,0 10-3 -xmax =0 ; xmax =1,0 10-3 mol. Volume total : 20+20 = 40 ml = 0,04 L ; [H3O+]= 10-3 / 0,04 = 0,025 mol/L ; pH = -log 0,025 = 1,6. D- On dilue 5 fois la solution S’, le pH augmente alors d’une unité. Faux. [H3O+]=0,025 / 5 = 0,005 mol/L ; pH = -log 0,005 =2,3.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|