|
Analyse d'un détartrant pour cafetière : conductimétrie, classification périodique ( bac Stl Biochimie, génie biologique 2009) |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
On souhaite déterminer le pourcentage massique d'acide sulfamique de ce détartrant. Pour cela, on réalise un titrage conductimétrique d'une solution de détartrant par une solution titrée d'hydroxyde de sodium. L'acide sulfamique de formule NH2SO3H est noté AH. L'acide sulfamique. Donner la définition d'un acide selon Brönsted. Espèce, ion ou molécule, susceptible de céder un proton H+. L'acide sulfamique se comporte comme un acide fort en solution aqueuse. Montrer que le pH d'une solution aqueuse d'acide sulfamique de concentration CA = 5,00 10-3 mol/L est pH = 2,3. Pour un acide fort, pH = - log CA = -log 5,00 10-3 = 2,3. Ecrire l'équation de la réaction de l'acide sulfamique avec l'eau. préciser le caractère total ou partiel de cette transformation chimique. Un acide fort réagit totalement avec l'eau : AH(aq) + H2O(l) ---> H3O+(aq) + A-(aq). Préparation de la solution S de détartrant. On prépare un volume VS = 200,0 mL de solution aqueuse S en dissolvant une masse mP = 1,00 g de poudre contenue dans un sachet de détartrant. Sur l'emballage du détartrant, il est indiqué : " Détartrant à base d'acide sulfamique - Irritant pour les yeux et la peau". Parmi les pictogrammes ci-dessous, quel est celui qui, illustrant ce risque, figure sur l'emballage ?
pictogramme b. Par dilution, on prépare un volume
Vl = 100,0 mL d'une solution aqueuse
Sb d'hydroxyde de sodium de
concentration Cb =1,00 10-1
mol/L, à partir d'une solution S0
de concentration C0 = 2,00 mol/L. Calculer le volume
V0 de solution S0 à
prélever. Facteur de dilution F = concentration
mère / concentration fille =C0 /
C b =2,00 / 0,100 = 20,0. Volume à prélever V0 =
Vl / F = 100,0 / 20,0 =
5,00 mL. - burette graduée de 25 mL - éprouvettes graduées de 10 mL, 20 mL et 100 mL - fioles jaugées de 50 mL, 100 mL et 200 mL - pipettes graduées de 1 mL et 5 mL - pipettes jaugées de 5 mL, 10 mL et 20 mL. Titrage conductimétrique. Pour effectuer ce titrage, on remplit une burette graduée de solution Sb d'hydroxyde de sodium ( soude Na+(aq) + HO-(aq) ) de concentration Cb = 1,00 10-1 mol /L. On prélève un volume
Va = 20,0 mL de solution S de détartrant
que l'on verse dans un becher. On ajoute environ 150 mL
d'eau distillée et on met le contenu du becher sous
agitation magnétique. On y immerge la cellule d'un
conductimètre préalablement
étalonné. On y verse progressivement
millilitre par millilitre la solution d'hydroxyde de sodium
et on relève la valeur de la conductivité du
mélange. Le tableau ci-dessous donne la
conductivité s
du mélange en fonction du volume Vb
de solution d'hydroxyde de sodium
versé.
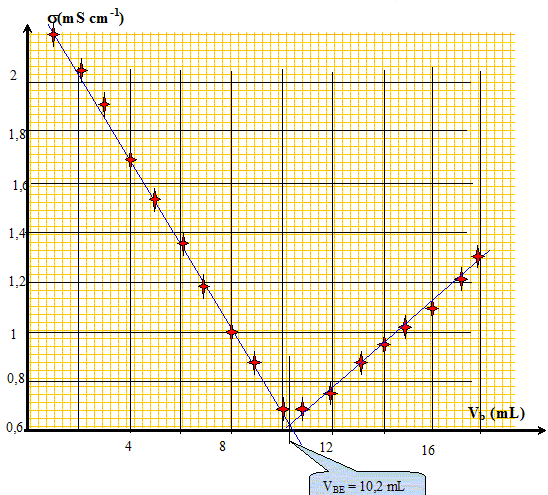
AH (aq) + HO-(aq) --->H2O(l) + A-(aq) Construire le graphe donnant l'évolution de la conductivité en fonction du volume Vb et déterminer la valeur du volume équivalent VE.
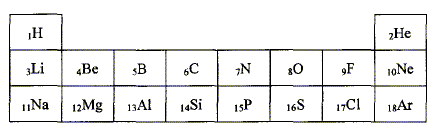
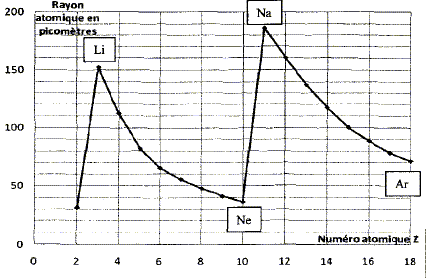
On souhaite déterminer le pourcentage massique d'acide sulfamique dans le détartrant. Exprimer puis calculer la concentration Ca en acide sulfamique de la solution S. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. Ca Va = Cb VBE ; Ca = Cb VBE / Va = 1,00 10-1 * 10,2 / 20,0 = 5,10 10-2 mol/L. Exprimer puis calculer la masse ma d'acide sulfamique présent dans l'échantillon de poudre de masse mP = 1,00 g. Quantité de matière d'acide sulfamique : n = Ca VS mol masse d'acide sulfamique (g) = quantité de matière (mol) * masse molaire de l'acide sulfamique ( g/mol) ma = n M = Ca VS M avec M = 97,1 g/mol. ma =5,10 10-2 * 0,200 * 97,1 =0,990 g. En déduire le pourcentage en masse d'acide sulfamique dans le détartrant commercial. ma *100 / mP = 0,990*100/1,00 = 99 %. A propos de la classification périodique. On considère trois éléments chimiques : - le bérylium 4Be, principalement présent dans la nature sous forme d'oxydes ( émeraude ) - le chlore 17Cl présent dans l'eau de mer et la croûte terrestre sous forme d'ion chlorure - l'argon 18Ar troisième constituant de l'air en volume. Donner la configuration électronique de chacun des atomes ci-dessus pris dans l'état fondamental. 4Be : 1 s2 2s2 ; 17Cl : 1 s2 2s2 2 p6 3s2 3p5 ; 18Ar : 1 s2 2s2 2 p6 3s2 3p6. Quels sont les ions que les éléments bérylium et chlore sont susceptibles de former. Justifier. Les éléments, au cours des réactions chimiques, ont tendance à compléter à 8 ( à 2 pour le bérylium ) ou encore à acquérir la structure électronique du gaz noble le plus proche. Lélément bérylium perd facilement deux électrons et donne l'ion Be2+. L'élément chlore gagne facilement un électron et donne l'ion Cl-. L'élément argon est présent dans la nature sous forme gazeuse à l'état atomique. Pourquoi,celui-ci n'a t-il pas tendance à former de liaisons chimiques avec d'autres éléments ? La couche électronique externe de l'élément argon est complète ( 8 électrons).
L'élément plomb donne avec les éléments de l'avant dernière colonne de la classification périodique des composés très peu solubles dans l'eau de formules respectives PbCl2, PbI2 et PbBr2. On s'interesse au chlorure de plomb (II) de formule PbCl2 à l'état solide. On prépare une solution saturée en chlorure de plomb (II) en dissolvant une quantité maximale de chlorure de plomb solide dans de l'eau pure. Un titrage effectué à 25 °C a permis de déterminer la concentration en ion chlorure : [Cl-] = 3,2 10-2 mol/L. En déduire la concentration en ions plomb(II) [Pb2+] de la solution saturée. La solution est électriquement neutre : 2[Pb2+] =[Cl-] ; [Pb2+] =½[Cl-] = 1,6 10-2 mol/L. Exprimer puis calculer le produit de solubilité Ks du chlorure de plomb à 25 °C. PbCl2(s) =Pb2+(aq) + 2Cl-(aq) Ks
=[Pb2+][Cl-]2
=1,6 10-2 *(3,2 10-2)2
=1,6
10-5.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|