|
Organomagnésien et chlorure d'acyle, déshydratation d'un alcool, effet Kharash, concours Mines 07 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
La suite des réactions est la suivante :
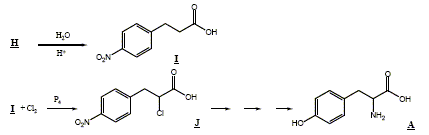
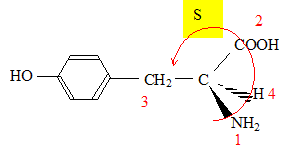
Le descripteur stéréochimique du carbone asymétrique de la tyrosine naturelle A est S (sinister). Classement des
substituants par ordre de priorité
décroissante : NH2 ; COOH ;
CH2-C6H4-OH ;
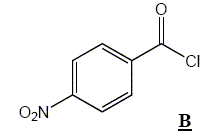
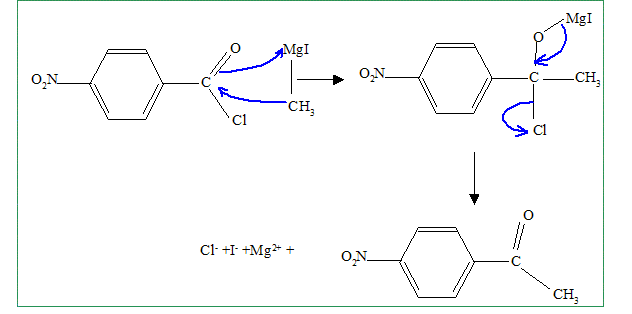
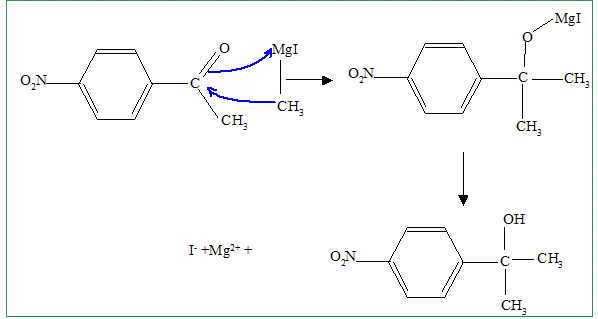
H. La réaction de synthèse de l’iodure de méthylmagnésium s’effectue dans l’éther anhydre (ou éthoxyéthane anhydre). Écrire l’équation de formation de l’organomagnésien. CH3I+ Mg (s)= CH3-Mg I Pourquoi cette synthèse doit-elle être faite dans un solvant anhydre ? Il faut travailler en milieu anhydre, sinon l'organomagnésien est détruit par l'eau ( la réaction est vive); de plus l'éther, par ses propriétés basiques, stabilise l'organomagnésien formé. Parmi les solvants disponibles dans le laboratoire, on trouve, outre l’éther, l’éthanol, le cyclohexane, l’éthylamine (ou éthanamine), l’acide acétique, le trichlorométhane et le THF. Dire pour chacun de ces solvants, en justifiant votre réponse, s’il convient ou non en remplacement de l’éther pour la synthèse de l’iodure de méthylmagnésium. L'organomagnésien est une base forte susceptible de réagir avec les solvants protiques : éthanol, acide éthanoïque, éthylamine sont donc exclus. Le solvant, une base de Lewis, doit stabiliser l'organomagnésien : cychlohexane exclu. Un organomagnésien réagit avec les dérivés chlorés : HCCl3 exclu. Seul le THF convient. Quel serait le produit obtenu, après hydrolyse acide, en faisant agir l’iodure de méthylmagnésium en excès, dans l'éther, sur le chlorure d’acyle B ? Donner le schéma
réactionnel.
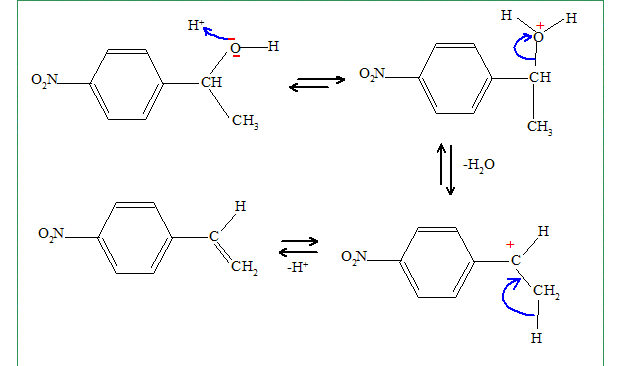
Proposer un mécanisme pour cette réaction. Préciser la formule semi développée de F. Quel est le rôle de l'acide phosphorique ? L'acide phosphorique, acide fort, protone l'oxygène du groupe alcool. H+ est régénéré en fin de réaction. H+ catalyse la réaction. H2O est un bon nucléofuge, d'autant plus que le carbocation plan résultant est stabilisé par résonance avec le noyau benzènique.
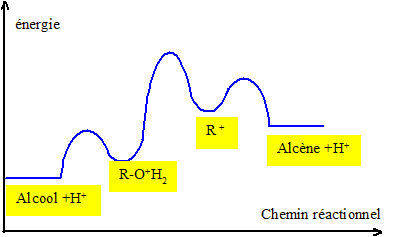
Sachant que la réaction de déshydratation est endothermique, tracer le profil énergetique de la réaction.
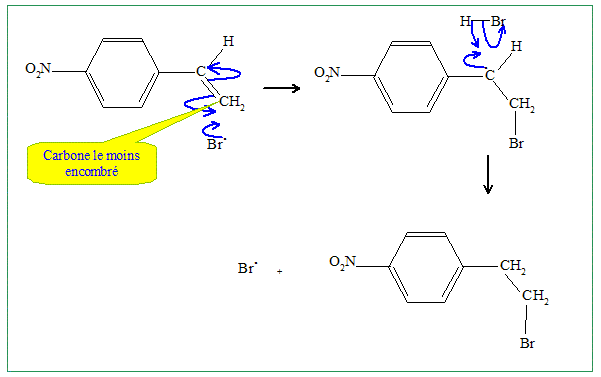
Proposer un mécanisme pour la réaction F-->G. Préciser la formule semi-développée de G. Effet Kharash, addition de HBr sur une double liaison en présence de peroxyde R-O-O-R et en milieu apolaire. Initiation : R-O-OR --> 2R-O.. R-O.+HBr --> ROH + Br.. Propagation :
Rupture de chaîne : 2 Br. --> Br2. Quel serait le produit majoritaire de la réaction en l'absence de peroxydes et en milieu polaire ? Addition suivant la règle de Markovnikov: on obtient le dérivé bromé secondaire O2N-C6H4-CHBr-CH3.
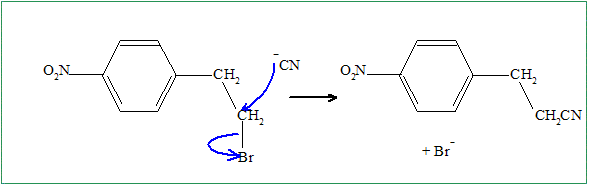
Proposer un mécanisme pour la réaction G-->H. Comment se nomme ce type de réaction ? Sur un dérivé bromé primaire, on observe une substitution nucléophile bimoléculaire ( SN2) plutôt qu'une SN1.
|
|||||||
|
|
|||||||
|
|