|
Espèces chimiques, chauffage à reflux, décantation lycée. En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||
| .
. |
|||||||||||||||||||
|
|||||||||||||||||||
|
Sur l'étiquette d'une boisson gazeuse on lit : ingrédients : eau gazéifiée, sucre, acide citrique, colorant, arôme artificiel.
corrigé La boisson contient de l'acide citrique ; elle est donc acide. Déposer une goutte de boisson sur un papier indicateur universel de pH et comparer à la gamme de couleur. Si le sucre est du glucose, le test à la liqueur de Fehling est positif. Les espèces chimiques naturelles sont : eau gazéifiée, glucose, acide citrique. Le gaz dissout est le dioxyde de carbone.
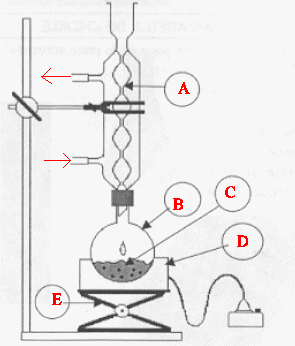
Dans un ballon on introduit 10 g d'alcool isoamylique C5H12O et 24 mL d'acide acétique CH3-COOH. On y ajoute de l'acide sulfurique concentré et quelques pierres ponce. Le mélange réactionnel est chauffé à reflux pendant 2 heures, puis on laisse refroidir le ballon. Le contenu de ce dernier est versé dans un bécher contenant 50 mL d'eau glacée. Agiter, puis transvaser dans une ampoule à décanter. Eliminer la phase aqueuse ; récupérer la phase organique ; laver celle-ci avec une solution saturée d'hydrogénocarbonate de sodium : on observe une effervescence. On élimine à nouveau la phase aqueuse ; dans la phase organique on ajoute du sulfate de magnésium anhydre ( on élimine ainsi l'eau restant dans la phase organique ) Purifier, sécher : on obtient 12 g d'ester. Quel est
l'intérêt du chauffage à
reflux ? Il augmente la vitesse d'une réaction
lente en travaillant à température
modérée. On évite les pertes de matière :
les vapeurs se condensent dans le
réfrigérant et retombent dans le
ballon. C5H12O +CH3-COOH = CH3-COO-C5H11 + H2O. Schéma du chauffage à reflux.
A : réfrigérant à eau ; : ballon ; D : chauffe ballon ; E : élévateur à croisillons.
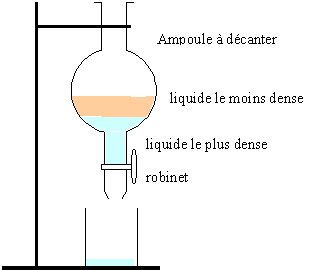
Décantation : Quelles sont les principales espèces chimiques contenues dans chaque phase ? phase aqueuse : acide acétique et l'acétate de sodium, l'eau,, hydrogénocarbonate de sodium, acide sulfurique. phase organique : l'ester, l'acétate d'isoamyle, l'alcool isoamylique( en cas d'excès)
La phase organique est la moins dense. Elle occupe la partie supérieure.
Lavage : A quoi sert l'opération de lavage ? Eliminer l'excès d'acide acétique et transformer ce dernier en acétate de sodium plus soluble dans l'eau. Eliminer l'acide sulfurique.
|
|||||||||||||||||||
|
|
|||||||||||||||||||
|
|