|
Acylation Friedel Crafts ; dimère Al2Cl6 ; organomagnésien concours Capes interne 2008 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||
| .
. |
|||||||||
|
|||||||||
|
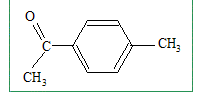
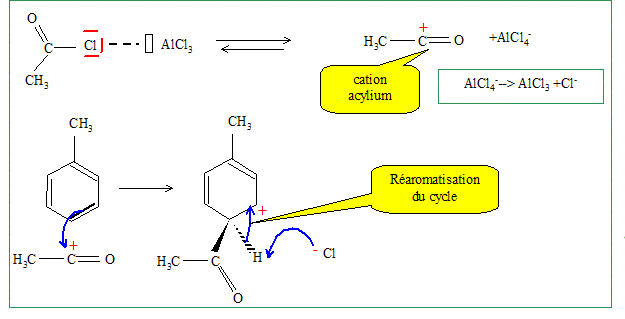
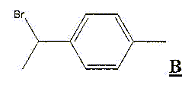
Il s'agit d'une acylation de Friedel et Crafts. Le produit A est obtenu majoritairement. De quel type de réaction s'agit-il? Donner la formule de A. Substitution électroplile sur le noyau benzénique.
Le chlorure d'éthanoyle peut être obtenu par action du chlorure de thionyle SOCl2 sur l'acide éthanoïque en présence de pyridine. Donner léquation de la réaction correspondante. SOCl2 +CH3-COOH --> CH3-COCl + SO2+HCl. Quel est le rôle de la pyridine ? Solvant polaire aprotique basique : neutralisation de HCl formé. en déduire sa
géométrie d'après la
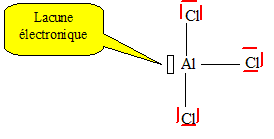
théorie VSEPR. Un doublet non liant occupe un volume moyen plus important qu'un doublet liant. Liaison multiple : le volume occupé par les électrons croît d'une liaison simple à une liaison triple ; cela entraîne une diminution de l'angle opposé la liaison multiple. Les angles seront donc inférieurs à 109°, plus proches de 95 à 100°. Le soufre peut ne pas respecter la règle de l'octet. Expliquer. présence des orbitales 3d vacantes.
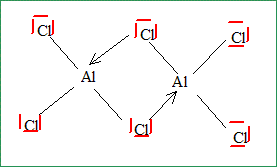
Expliquer et donner le schéma de Lewis du dimère. Un atome est d'autant plus stable qu'il satisfait à la règle de l'octet : c'est le cas de l'aluminium dans le dimère.
Les positions en ortho du méthyle étant encombrées, la substitution est majoritaire en para.
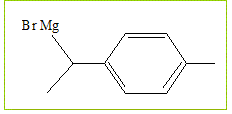
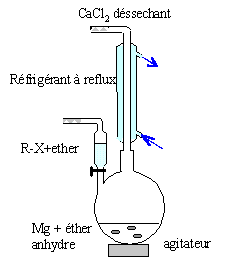
Le composé B est mis en solution dans l'éthoxyéthane Et2O anhydre. On ajoute des copeaux de magnésium et on obtient C.
Donner la formule de C formé.
A quelle famille de de composé appartient-il ? Quel est le nom du chercheur qui obtint le prix Nobel pour leur découverte ? Organomagnésiens ; V. Grignard. Pourquoi le solvant doit-il être anhydre ? Il faut travailler en milieu
anhydre, sinon l'organomagnésien est détruit
par l'eau ( la réaction est vive); de plus
l'éther, par ses propriétés basiques,
stabilise l'organomagnésien formé. colonne Vigeux ou réfrigérant
droit surmonté d'un dispositif
déshydratant contenant CaCl2. ampoule de coulée ; ajout goutte à
goutte du dérivé bromé ballon bicol contenant de l'éther anhydre
et les copeaux de magnésium Dispositif d'agitation RBr + RMgBr = R-R + MgBr2. On l'évite en ajoutant goutte à goutte le dérivé bromé et en utilisant le magnésium en excès.
L'éthoxyéthane peut être synthétisé par synthèse de Williamson. On fait réagir le sodium solide sur l'éthanol en milieu anhydre puis on ajoute du chloroéthane. Donner l'équation de la réaction du sodium solide sur l'éthanol. De quel type de réaction s'agit-il ? C2H5OH + Na = C2H5O- + Na+ + ½H2. Le nombre d'oxydation du sodium varie, il passe de 0 à +I : il s'agit d'une oxydoréduction. Pourquoi ne peut-on pas obtenir l'ion éthanolate par action d'une solution aqueuse d'hydroxyde de sodium sur l'éthanol ? L'eau est un acide beaucoup plus fort que l'éthanol. La base conjuguée de l'éthanol, l'ion éthanolate, est une base beaucoup plus forte que l'eau. Le transfert de proton de l'éthanol à l'eau n'est pas réalisable. La réaction prépondérante a lieu entre la base la plus forte, l'ion éthanolate, et l'acide le plus fort, l'eau.
|
|||||||||
|
|
|||||||||
|
|