|
Synthèse d'un fébrifuge, l'acétanilide bac S Asie 2008. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
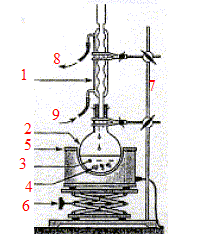
Au lycée, on prépare l'acétanilide en suivant le protocole suivant : étape 1 : dans un ballon propre et sec, introduire V1 = 15 mL d'acide éthanoïque qui joue le rôle de solvant, V2 = 15,0 mL d'anhydride éthanoïque, V3 = 10,0 ml d'aniline et quelques grains de pierre ponce. - adapter sur le ballon rodé un réfrigérant à boules ; chauffer le ballon au bain-marie à 80 °C pendant 20 minutes. - retirer le ballon du bain-marie et verser immédiatement par le sommet du réfrigérant 10 mL d'eau sans attendre le refroidissement en faisant atention aux vapeurs chaudes d'acides - lorsque l'ébullition cesse, ajouter 50 mL d'eau froide et agiter à température ambiante jusqu'à apparition de cristaux - losque les premiers cristaux blancs apparaissent, ajouter 50 mL d'eau glacée et refroidir le ballon dans la glac jusqu'à cristallisation complète - effectuer une filtration sous vide en rinçant à l'eau distillée froide.
- dans un bécher, faire chauffer environ
50 mL d'eau et y dissoudre la totalité du
produit obtenu à l'étape 1 - après dissolution attendre la
crostallisation - effectuer une filtration sous vide - placer le produit dans une coupelle
préalablement pesée - sécher à l'étuve à
90°C - la masse du produit est m = 11,6 g.
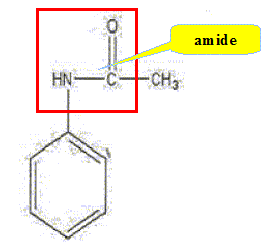
Entourer le groupe caractéristique amide.
rendement de la synthèse. L'équation de la réaction entre l'aniline et l'anhydride éthanoïque est : 1 aniline + 1 anhydride éthanoïque = 1 acétanilide + 1 A. La quantité de matière initiale d'aniline est 0,110 mol. Quel est le nom du composé A de l'équation de la réaction ? acide éthanoïque CH3-COOH. Calculer la quantité de matière initiale d'anhydride éthanoïque.
Quel est le réactif limitant ?
Si l'anhydride éthanoïque est en défaut : 0,159-xmax =0 ; xmax =0,159. On retient la plus petite valeur : l'aniline est le réactif limitant.
Quelle masse maximale d'acétanilide peut-on espérer obtenir ? Quantité de matière maximale = xmax = 0,110 mol
Définir et calculer le rendement de cette synthèse. rendement = masse réelle / masse théorique *100 =11,6*100/14,85 = 78,1 %.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|