|
Agrégation 2006 : cristallochimie, oxyde de nickel. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||
| .
. |
|||
|
|||
|
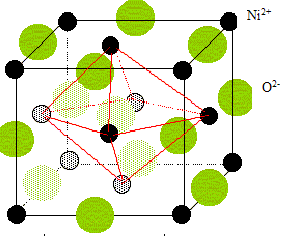
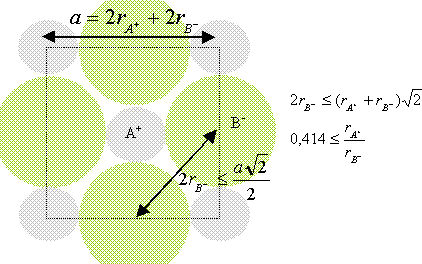
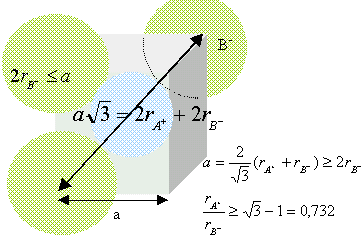
Nombre de motif par maille ( ou population) : Chaque ion oxyde, situé au milieu d'un coté appartient à 4 cubes et compte donc pour 1/4 ; il y a douze cotés ; par suite 3 ions oxyde par maille. Ajoutons l'ion O2- situé au centre du cube : total 4 ions O2- par maille. Chaque ion nickel, situé à un sommet appartient à 8 cubes et compte donc pour 1/8 ; il y a 8 sommets : par suite 1 ion Ni2+ pour la maille. Chaque ion nickel, situé au centre d'une face appartient à 8 cubes et compte donc pour 1/2 ; il y a 6 faces : par suite 3 ions Ni2+ pour la maille. total 4 ions Ni2+ par maille. Coordinence ou nombre de plus proches voisins de signe contraire = 6: Chaque ions se trouve au centre d'un octaèdre dont les sommets sont occupés par des ions de signe contraire. Rapport des rayons ioniques du cation et de l'anion dans cette structure : ( modèle des sphères dures) conditions pour que AB cristallise dans un réseau type NaCl : représentons une section de la maille, les anions étant plus gros que les cations.
Ce modèle des sphères dures ne s'applique plus si l'anion est polarisable et si le cation est polarisant.
a = 2(RNi2+ +
RO2- )=2(72+140)=424
pm.
volume de la maille : V= a3 = (4,24 10-10)3 = 7,62 10-29 m3. m : masse de 4 motifs NiO contenus dans une maille : Masse molaire NiO = M= 59+16=75 g/mol m =4 M 10-3/NA= 4*75 10-3/6,02 1023=4,98 10-25 kg masse volumique r= m/V =4,98 10-25 / 7,62 10-29 =6,53 103 kg m-3.
|
|||
|
|
|||
|
|