|
Concours Kiné : chimie organique, acide base, cinétique d'une saponification 2007 ( Nantes) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
|
Question 1 :
Question 2 :
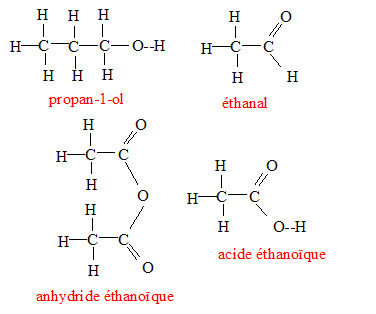
2 fois { MnO4- + 8 H++ 5e- = Mn2++ 4H2O} 5 fois { CH3-CHO + H2O = CH3-COOH + 2++ 2e- } 2MnO4- +5CH3-CHO+ 6 H+ =2 Mn2++5CH3-COOH + 3H2O Question 3 :
CH3-COOH + H2O = CH3-COO- + H3O+ ; Ka = [CH3-COO-]éq[H3O+]éq/[CH3-COOH]éq. [H3O+] = 10-pH = 10-2,9 = 1,26 10-3 mol/L. t = xmax / xfin avec xmax = 0,01 mol ; xfin =[H3O+] *V = 1,26 10-3*0,1 = 1,26 10-4 mol. t = 1,26 10-2. Calcul de Ka : solution électriquement neutre : [H3O+] =[CH3-COO-] conservation de l'élément carbone : [CH3-COO-] +[CH3-COOH] = 0,1 d'où [CH3-COOH] = 0,0987. Ka =(1,26 10-3)2/0,0987 =1,6 10-5. Question 4 :
CH3-COOH + CH3-CH2-CH2OH = CH3-COO-CH2-CH2-CH3 + H2O lente, limitée par l'hydrolyse de l'ester, athermique. (CH3-CO)2O + CH3-CH2-CH2OH --> CH3-COO-CH2-CH2-CH3 + CH3-COOH rapide, totale, exothermique.
Question 5 :
CH3-COO-CH2-CH2-CH3 +Na+ + HO- = CH3-COO- + Na+ +CH3-CH2-CH2OH
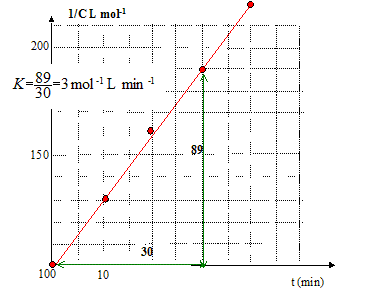
Equation de la droite : 1/C = Kt + 1/C0 (1) expression littérale de C : (C0-C) / (CC0) = Kt ; C0-C = CC0Kt ; C= C0/(1+C0Kt). vitesse volumique de la réaction : v = -dC/dt différentier (1) : -dC/C2 = Kdt ; -dC/dt = KC2. a = 2. temps de demi-réaction t½ : à t½, la concentration C est égale à ½C0 d'où d'après (1) : 1/C0=Kt½ ; t½ =1/(C0K) =1/(0,01*3) = 33 min. vitesse volumique de la réaction : v(t=0 ) =KC02 = 3*0,012 = 3 10-4 mol L-1 min-1. v(t=t½ ) =K(½C0)2 = 7,5 10-5 mol L-1 min-1.
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|