|
concours Geipi Eni pile cuivre- zinc. 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
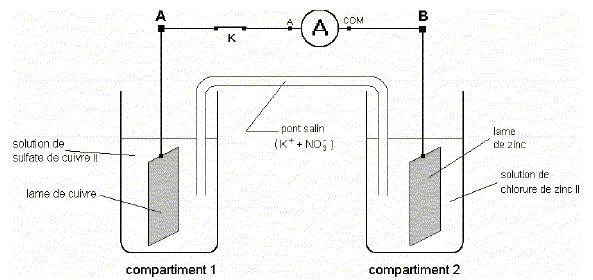
On sait par ailleurs que : - Lorsqu’une lame de zinc est plongée dans une solution de sulfate de cuivre, elle se recouvre d’un solide rougeâtre. - Aucune observation n’est à mentionner lorsqu’on plonge une lame de cuivre dans le chlorure de zinc. Le zinc, le réducteur s'oxyde et libère des électrons : il constitue la borne - de la pile. Zn(s) = Zn2+(aq) + 2e-. Le zinc est une anode. Les ions Cu2+ se réduisent à la cathode ( plaque de cuivre) positive : Cu2+(aq) + 2e-= Cu(s). Electrodes A. A est le pôle + ; B est l’anode ; le zinc subit l’oxydation. Vrai. B. Il y a oxydation du cuivre à l’anode ; les ions Zn2+ subissent une réduction ; B est le pôle -. Faux. C. A est le pôle - ; l’électrode du compartiment 2 est l’anode ; le cuivre subit une réduction. Faux. D. Il y a oxydation du zinc à la cathode ; B est le pôle - ; les ions Cu2+ sont réduits. Faux. E. Le zinc subit l’oxydation ; A est la cathode ; B est le pôle +. Faux.
A. L’intensité du courant diminue dans le temps ; la concentration en Zn2+ reste constante ; la masse de Cu augmente. Faux. B. La concentration en Cu2+ diminue avec le temps ; la masse de Cu reste constante ; la masse de Zn diminue. Faux. C. La concentration des ions Zn2+ augmente avec le temps ; la masse de Cu augmente ; le compartiment 2 se concentre en ions Cu2+. Faux. D. Les deux concentrations en Cu2+ et Zn2+ tendent à s’égaler ; la masse de Cu diminue ; la masse totale du système reste constante. Faux. E. L’intensité tend à s’annuler ; la masse de Zn diminue ; la concentration en ions Cu2+ diminue. Vrai.
A. Des électrons circulent dans le pont salin du compartiment 1 vers le compartiment 2 ; on mesure I < 0 ; l’intensité décroît dans le temps. Faux. Les électrons circulent dans les métaux. B. On mesure I > 0 ; un courant électrique circule dans le pont salin du compartiment 2 vers le compartiment 1 ; les ions NO3- circulent en sens inverse du courant. Vrai. C. Les ions K+ suivent le sens du courant ; l’intensité décroît avec le temps ; des électrons circulent dans le pont salin du compartiment 2 vers le compartiment 1. Faux. D. L’intensité du courant dans le pont salin est égale à celle du courant mesuré par l’ampèremètre ; les ions NO3- suivent le sens du courant ; des électrons circulent dans le segment AB de B vers A. Faux. Les électrons dans les métaux, les ions négatifs dans les solutions et le pont salin se déplacent en sens contraire du courant. E. L’intensité augmente si la concentration en CuCl2 augmente ; des électrons circulent dans le segment AB de A vers B ; on mesure I < 0. Faux. On mesure I positif , la borne COM de l'ampèremètre est reliée à la borne négative de la pile.
Lorsqu’on ouvre l’interrupteur K : A. Le pont salin devient le siège d’une électrolyse ; la tension UAB = 0 ; l’intensité dans le segment AB est nulle. Faux. Le circuit est ouvert : pas d'électrolyse, l'intensité est nulle. B. Aucune réaction électrochimique n’est observée ; la tension UAB > 0 ; l’intensité mesurée est nulle. Vrai. C. L'intensité mesurée I = 0 ; les deux électrodes adoptent le même potentiel ; la composition chimique des deux demi-piles reste constante. Faux. Les deux électrodes sont à des potentiels différents. D. Le système électrochimique retrouve l’état d’équilibre ; la tension UAB < 0 ; aucun courant ne parcourt le pont salin. Faux. E. Les concentrations en ions restent constantes dans les deux compartiments ; la tension UAB s’annule ; le système est à l’équilibre. Faux.
|
|
|
|
|
|
|