|
chimie
organique, calcul de pH, spectrométrie de masse,
chromatographie en phase gazeuse concours
Cnrs 2003 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
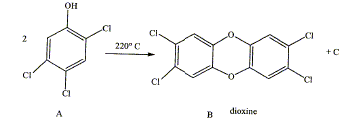
La dioxine est produite à partir du 1,2,4,5-tétrachlorobenzène antiseptique utilisé dans l'industrie pharmaceutique et c'est un intermédiaire dans la fabrication des pesticides ( contre termites).
Nommer les groupes caractéristiques (fonction chimique ) des produits A et B. Equilibrer la réaction A donnant B, quel composé C se forme ? Comment mettre en évidence la nature chimique de C ? Comment le détruire.
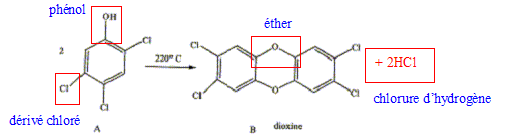
Le chlorure d'hydrogène est très soluble dans l'eau : il donne une solution d'acide chlorhydrique. Celle-ci en présence d'une base conduit à
un sel.
Soit les réactions successives suivantes : (A) CH3-CH2-CH2OH ---> (B) CH3-CH2-CHO ---> (C) CH3-CH2-COOH Donner la formule développée de ces produits. Quelles sont les fonctions chimiques de ces produits ? Ces réactions sont-elles des réactions de réduction, d'hydrolyse, de couplage, d'oxydation ? Deux produits parmi A, B, C peuvent réagir ensemble, lesquels ? Ecrire la réaction ; quel est son nom ? Est une réaction totalement déplacée, équilibrée, ne se fait pas. En cas de réponse "équilibrée", comment déplacer l'équilibre ? 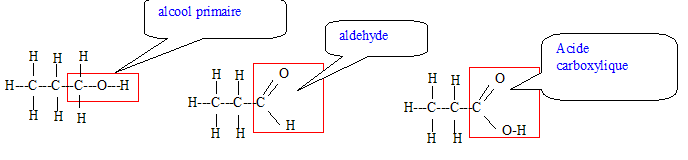
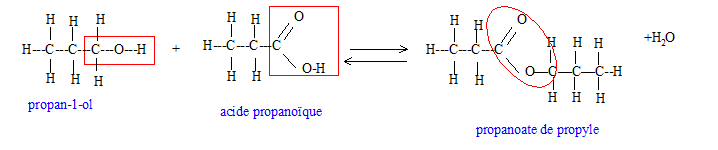
Réaction d'oxydation ménagée d'un alcool primaire en aldehyde puis acide carboxylique. L'alcool A peut réagir avec l'acide carboxylique C pour conduire à un ester et de l'eau.
La réaction d'estérification est limitée équilibrée ) par l'hydrolyse de l'ester. En utilisant un réactif en excès ( ou en éliminant l'un des produits au fur et à mesure qu'il se forme), on déplace l'équilibre vers la droite, formation de l'ester.
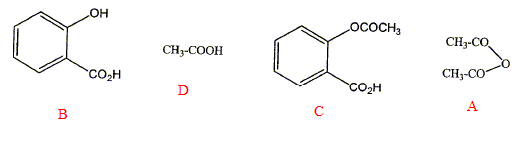
Question 3 : Synthèse d'un ester à partir d'un anhydride d'acide et d'un alcool. L'aspirine est préparée suivant cette réaction. L'ester C est ici l'aspirine ou acide acéthylsalicylique. (A) anhydride d'acide + (B) alcool ---> (C) ester + (D) acide carboxylique. Les produits de la réaction sont listés ci-dessous : attribuer à chacun d'eux la lettre A, B, C ou D correspondant à leur fonction.
On souhaite préparer 100 kg d'aspirine, le rendement théorique de la réaction est 95 %. Quelle masse d'acide salicylique faut-il utiliser ? (C : 12 ; H : 1 ; o : 16 g/mol)
Masse molaire de l'aspirine C9H8O4 : M = 9*12+8+4*16 = 180 g/mol Quantité de matière d'aspirine (mol) = masse (g) / masse molaire (g/mol) n(aspirine) = 100 000 / 180 = 555,56 mol D'après les coefficients stoemétriques de l'équation : n(aspirine) = n( acide salicylique) masse (g) = quantité de matière(mol) * masse molaire (g/mol) m(acide salycilique) = 555,56*138 = 76,66 kg tenir compte du rendement : 76,66 /
0,95 = 80,7
kg.
Dans un catalogue de produits chimiques on a relevé les informations suivantes : "glutaraldéhyde 25 % en solution ; C5H8O2 ; M= 100,12 g/mol ; d=1,06. Quelle est la concentration du
glutaraldéhyde en solution ?
Quantité de matière
de glutaraldéhyde en solution = masse (g) / masse
molaire (g/mol) = 265/100,12 =
2,65 mol dans 1
L.
couple
(NH4+ / NH3) :
pKa =9,26.
[NH3] /[NH4+] =5,75 On note v (mL) le volume de solution de NH4Cl ajouté : [NH4+] =0,34 v/(250+v) ; [NH3] =0,82*250/(250+v) [NH3]
/[NH4+] =0,82*250/0,34 v =
5,75 ; v= 0,82*250 /(0,34*5,75)
=105
mL.
De quelle(s) façon(s) peut-on procéder ? Le facteur de dilution est : 1/0,0005 = 2000. - 2 dilutions successives : 5 mL dans une fiole jaugée de 100 mL, puis 10 mL dans une fiole jaugée de 1000 mL Facteur de dilution : 100/5 * 1000/10 = 20*100=2000 ( correct). -2 dilutions successives : 20 mL dans une fiole jaugée de 100 mL, puis 5 mL dans une fiole jaugée de 1000 mL. Facteur de dilution : 100/20 * 1000/5 = 5*200=1000 ( incorrect). - 2 dilutions successives : 5 mL dans une fiole jaugée de 50 mL, puis 5 mL dans une fiole jaugée de 1000 mL. Facteur de dilution : 50/5 * 1000/5 = 10*200=2000 (correct). - 2 dilutions successives : 25 mL dans une fiole jaugée de 1000 mL, puis 20 mL dans une fiole jaugée de 1000 mL. Facteur de dilution : 1000/25 *
1000/20 = 40*50=2000
(correct).
pico = 10-12 ; femto = 10-15 ; nano = 10-9 ; micro = 10-6 ; atto = 10-18; déci = 0,1.
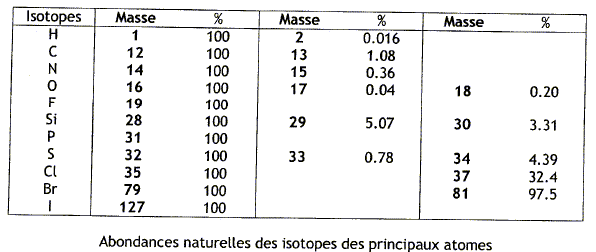
L'ionisation est une opération permettant de produire : - Un ion à partir d'un atome ou d'une molécule neutre. (correct) - un atome à partir d'un atome ou d'une molécule neutre. - Une molécule neutre à partir d'un atome ou d'un ion. Un spectromètre de masse est : - Un instrument qui analyse les molécules suivant le rapport m/z. - Un instrument qui analyse les ions suivant le rapport m/z. (correct ) - Un instrument qui analyse les composés suivant le rapport m/z. Lors de l'analyse par spectromètrie de masse, on produit des ions moléculaires, de quoi s'agit-il ? - Un ion issu d'une molécule par perte ou gain d'un proton. - Un ion issu d'une molécule par perte ou gain d'un électron. (correct) - Un ion issu d'une molécule par perte ou gain d'un neutron. L'analyse par spectromtrie de masse du benzène permet de détecter un pic intense à M= m/z = 78, ceci correspnd au pic de base du spectre. Un pic plus petit apparaît à M+1 = 79. Comment expliquer la présence de ce pic ? Quelle est son abondance relative ?
La présence de ce pic est dues aux isotopes du carbone ( 13C : 1,08%) et de l'hydrogène ( 2H : 0,016%). Abondance relative : 1,08+0,016 =
1,1 %.
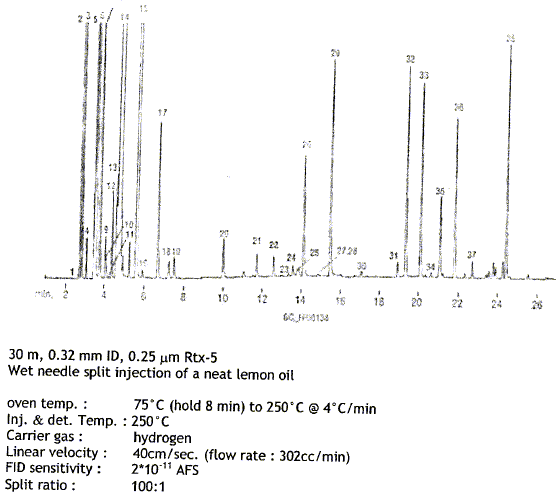
La grandeur expérimentale caractéristique est le temps de rétention, cette grandeur est-elle dépendante ou indépendante des paramètrs suivants : - Débit du gaz porteur ( dépendant) - Quantité injecée ( indépendante) - Nature et abondance des autres constituants, s'ils sont bien séparés ( indépendante). - Phase stationaire ( dépendant) - Température de la colonne
( dépendant).
La colonne est-elle polaire, apolaire ? apolaire.( 5% diphényl : substituant apolaire) Parmi les 38 composés détectés, attribuer l'ordre de sortie aux composés suivants ( la valeur indiquée entre parenthèse correspond à la température d'ébullition) limonène (176° ), géraniol (230° ), nérol (224°), linalol (198°), camphène (159°). Séparation des produits suivant leur point d'ébullition ; les composés ayant les points d'ébullition les plus élevés sont les plus polaires. Ils présentent peu d'affinité pour la phase fixe d'où l'ordre de sortie : géraniol, nérol, linalol, limonène, camphène. Le temps de rétention du composé 33 est de 20 min, quelle est la température du four ? Quel type de détecteur a été utilisé ? détecteur à ionisation de flamme : très sensible Citez trois autre détecteurs utilisables en chromatographie en phase gazeuse. - détecteur électrique, basé sur le principe du pont de Wheatstone ( catharomètre ) - détecteur à absorption électronique - spectromètre de masse et la spectroscopie infrarouge. |
|
|
|
|
|
|