|
d'après concours adjoint technique principal de laboratoire 2007: option B : physique chimie En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
Dans une boîtes ont entreposées diverses lentilles : Comment distinguer rapidement les lentilles convergentes des lentilles divergentes ? Les lentilles convergentes sont plus épaisses au centre que sur les bords. Les lentilles divergentes sont plus
épaisses sur les bords que dans leur partie centrale.
Comment déterminer rapidement l'ordre de grandeur de sa distance focale ? On réalise l'image d'un
objet éloigné : la distance lentille image
donne une valeur approximative de la distance focale.
Est ce une lentille divergente ou convergente ? Justifier Une lentille convergente possède une vergence positive. Une lentille divergente
possède une vergence négative.
Quelle est sa distance focale ? La distance focale est égale
à l'inverse de la vergence : f' = 1/20 = 0,05 m =
5
cm.
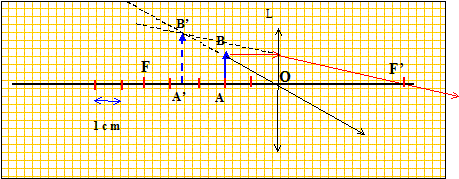
Construire un schéma à l'échelle représentant cette situation et tracer les rayons qui permettent de trouver l'image de cet objet. Indiquer sur le schéma la position de l'image.
Cette image est-elle projetable sur un écran ? Non. Quel nom donne t-on à ce type d'image ? vitrtuelle.
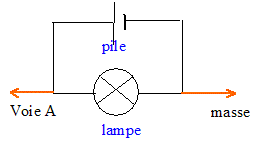
Electricité : On veut visualiser la tension aux bornes d'une lampe alimentée par un générateur basses fréquences. Représenter le montage du schéma utilisé en indiquant précisément les bornes de l'oscilloscope nécessaire pour visualiser cette tension.
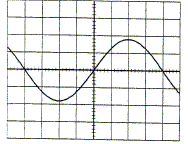
Préciser les caractéristiques de la tension visualisée : forme, période, fréquence, valeur maximale, valeur efficace. Forme sinusoïdale ; Une période correspond à 8 carreaux soit 0,2*8 = 1,6 ms ; T= 1,6 10-3 s. Fréquence = 1/T = 1000/1,6 ; f= 625 Hz. Amplitude ou valeur maximale : 1,8 carreaux soit 1,8*5 = 9 V. Valeur efficace : 9 / 1,414 = 6,4 V.
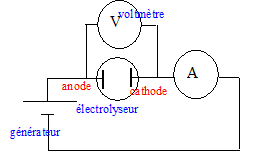
Schématiser le dispositif en indiquant des légendes.
Sur chaque électrode retourner un petit tube à essai rempli d'eau : H2 se dégage à la cathode et O2 à l'anode. Ces deux gaz sont pratiquement insolubles dans l'eau.
Dilution d'une solution d'acide chlorhydrique. On souhaite préparer 1,00 L d'une solution d'acide chlorhydrique de concentration 1,0 mol/L à partir d'une solution de concentration 10 mol/L. Quelles précautions particulières faut-il prendre pour réaliser cette dilution ? L'acide étant corrosif, port de blouse, gants et lunettes de protection. Dans la liste proposée, énumérer le matériel nécessaire pour faire cette dilution : pipette jaugée de 10 mL, éprouvette graduée de 10 mL, pipette graduée de 1 mL, fiole jaugée de 100 mL, bécher de 1 L, fiole jaugée de 1 L. Le facteur de dilution est égal à 10 : le volume de la prise d'acide concentré sera égal au 1 /10 ème du volume de la solution diluée ( 1L) Fiole jaugée de 1 L et fiole jaugée de 100 mL. Détailler le mode opératoire : verser la solution concentrée dans la fiole jaugée de 100 mL jusqu'au trait de jauge. Verser un peu d'eau distillée dans la fiole jaugée de 1 L puis y verser le contenu de la fiole jaugée de 100 mL. Rincer la fiole jaugée de 100 mL : l'eau de rinçage est placée dans la fiole jaugée de 1L. Compléter la fiole jaugée de 1 L avec de l'eau distillée jusqu' au trait de jauge. Boucher et agiter pour rendre homogène.
Quelle masse de sulfate de cuivre pentahydraté CuSO4, 5 H2O faut-il peser pour préparer 1 L d'une solution aqueuse de sulfate de cuivre de concentration 0,01 mol/L ? Cu : 63,5 ; S : 32 ; O : 16 ; H : 1 g/mol. Masse molaire : M= 63,5+32+4*16 + 5*18 =249,5 g/mol La solution contient 0,01 mol de sulfate de cuivre. masse (g) = masse molaire (g/mol) * quantité de matière (mol) m = 249,5 *0,01 = 2,5 g.
|
|
|
|
|
|
|