|
concours kiné APHP pile argent étain. 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
- Sn(s) / Sn2+(aq) + 2 Cl-(aq)// Ag+(aq) + NO3-(aq) / Ag(s) +. On dispose d'une lame d'étain, d'une lame d'argent,d'une solution de nitrate d'argent de concentration molaire volumique 0,10 mol/L, d'une solution de chlorure d'étain de concentration molaire volumique 0,10 mol/L, d'un pont salin contenant une solution saturée de nitrate de potassium K+(aq)+ NO3-(aq) et de bechers.
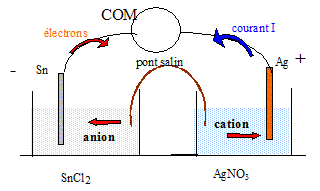
La tension lue sur le voltmère est positive ( la borne COM étant reliée à la borne - de la pile). Les électrons, dans les fils conducteurs et les plaques, se déplacent en sens contraire du sens conventionel du courant. Dans les solutions, les cations Ag+ et Sn2+ migrent dans le sens du courant, les anions Cl- et NO3- migrent en sens contraire. Equation de la réaction traduisant le fonctionnement de la pile : A l'anode négative, oxydation de l'étain : Sn = Sn2+(aq) + 2e-. En conséquence : - La masse de la plaque d'étain diminue. - La concentration en ion étain augmente dans le becher : il en résulte une migration des ions NO3-(aq) du pont salin afin que la solution de chlorure d'étain reste électriquement neutre. A la cathode positive, réduction des ions argent : 2Ag+(aq) + 2e- = 2Ag(s). En conséquence : - La masse de la plaque d'argent augmente. - La concentration en ion Ag+(aq) diminue dans le becher : il en résulte une migration des ions K+(aq) du pont salin afin que la solution de nitrate d'argent reste électriquement neutre. 2Ag+(aq) + Sn = Sn2+(aq) +2Ag(s). Rôle du pont salin : - Assure la continuité électrique en reliant les deux électrolytes. - Assure l'électroneutralité électrique des deux solutions. Expression littérale de la variation de masse de l'électrode d'étain au cours de ce fonctionnement : Dm <0. Cette pile est utilisée
pendant Dt
=600 s pour faire fonctionner une DEL,
l'intensité du courant électrique étant
I=0,050 A. Quantité de matière d'électron : n(e-) = IDt / F. Quantité de matière d'étain : n(Sn) = ½ n(e-) = ½ IDt / F. masse d'étain m (g) = M(Sn) * n(Sn) = ½ M(Sn) IDt / F. Valeur approchée de cette variation : m =0,5*0,05 *120*600 / 105= 1,8 10-2 g.
|
|
|
|
|
|
|