|
Les anomères du D-glucose ; étude d'un glycoside protecteur concours agrégation 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||
| .
. |
||||
|
||||
|
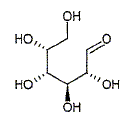
On sait depuis longtemps que, comme le saccharose, de nombreux sucres et féculents peuvent libérer du glucose, combustible le plus important des cellules biologiques. Mais, plus récemment, on a montré que le glucose n'est pas uniquement une source d'énergie : il intervient par exemple dans les processus de reconnaissance de protéine, ou plus simplement dans des rôles de stabilisation ou protection de fonction, point que nous allons étudier. Les anomères du D-glucose. Le glucose naturel est du D-glucose : il existe partiellement sous une forme ouverte aldehydique représentée ci-dessous :
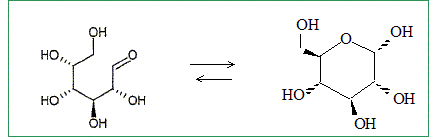
Quelle est la signification stéréochimique de la lettre D ? Dextrogyre : propriété d'une molécule de faire dévier le plan de polarisation de la lumière polarisée vers la droite. Nommer le glucose en nomenclature officielle ( sans indiquer les configuration absolue des atomes de carbone ? 2, 3, 4, 5, 6-pentahydroxyhexanal. Le D-glucose existe majoritairement sous forme cyclique. Donner le nom et l'équation de la réaction chimique intramoléculaire qui permet la cyclisation. Hémiacétalisation intramoléculaire : réaction entre un aldehyde et un alcool
Pourquoi la réaction intramoléculaire est-elle plus favorable que la réaction intermoléculaire ? Il s'agit d'une réaction sous contrôle thermodynamique. Montrons que Kintra est supérieure à Kinter. Dans les deux cas, les mêmes liaisons sont formées et rompues : donc DrH°inter = DrH°intra. Dans le cas d'une réaction intramoléculaire, le nombre de molécules reste le même : donc DrS°intra=0 Dans le cas d'une réaction intermoléculaire, le nombre de molécules diminue : donc DrS°inter<0. Or DrG° = DrH° -TDrS° : donc DrG°intra < DrG°inter De plus DrG° = -RTln K : donc Kintra >Kinter.
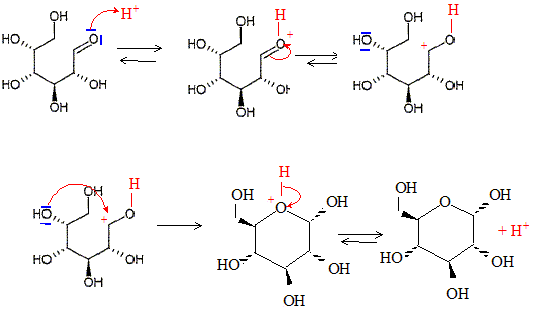
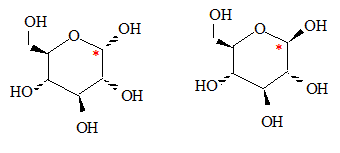
Montrer que la cyclisation conduit à 2 stéréoisomères de configuration, appelés anomères. Quelle est leur relation de stéréoisomérie ? L'atome de carbone du groupe carbonyle ( aldehyde) est trigonal plan. L'attaque de H+ se fait indifféremment d'un côté ou de l'autre du plan. Dans la forme cyclique du glucose un nouvel atome de carbone est créé : sa configuration est R ou S suivant le côté de l'attaque par H+. D'où les deux énantiomères :
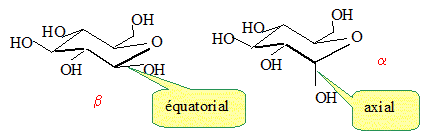
Représenter les deux anomères dans leur configuration la plus stable. Forme chaise du cycle à 6 atomes.
Lequel des deux anomères est le plus stable ? On le nommera b et l'autre a. L'anomère le plus stable est celui où tous les groupes sont en position équatoriale.
Inversement si on dissout du b-D-glucose dans l'eau, le pouvoir rotatoire spécifique augmente et se stabilise à la même valeur. pouvoir rotatoire spécifique du a-D-glucose à 25°C : + 112 ; pouvoir rotatoire spécifique du b-D-glucose à 25°C : + 19,0 ; pouvoir rotatoire spécifique du glucose à l'équilibre à 25°C : + 52,2 ; Interpréter ces résultats. Equilibres entre l'anomère a, la forme ouverte du glucose et l'anomère b. anomère a = forme ouverte du glucose = anomère b. En faisant une approximation que l'on précisera, calculer la composition du mélange à 25 °C. Le glucose est essentiellement sous forme cyclique ; le glucose sous forme ouverte peut être négligé. Soit x la fraction massique du a-D-glucose: [a] = [a] a x +[a]b (1-x) 52,2=112 x +19 (1-x) 52,2-19 = (112-19) x ;
x =
0,36.
Etude d'un glycoside protecteur. De nombreux fruits contiennent de l'acide cyanhydrique dans leur pépins ou dans les amandes de leurs noyaux. Donner la formule de Lewis et la géométrie de cette molécule d'après le modèle VSEPR.
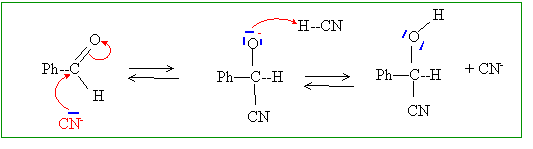
L'acide cyanhydrique HCN y est souvent associé à un aldehyde, comme le benzaldehyde Ph-CHO, noté A, selon la réaction renversable de formation du mandélonitrile Ph-CHOH-CN, noté B, d'équation (1) : Ph-CHO + HCN = Ph-CHOH-CN (1) Proposer un mécanisme pour cette réaction, en milieu aqueux au pH biologique. pKa du couple HCN/CN- : 9,2; à pH =7, un petit nombre d'ion cyanure CN- sont présents.
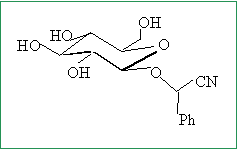
Afin de stabiliser le mandélonitrile B, le glucose réagit par sa fonction alcool anomérique sur la fonction alcool de B pour former un b-O-glycoside, noté C, comportant une fonction acétal. Représenter C en perspective.
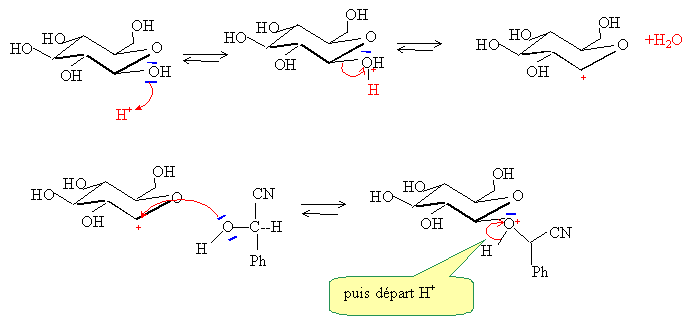
Ecrire le mécanisme de sa formation en milieu acide.
Pourquoi ne faut-il tout de même pas manger les pépins ou les amandes des noyaux de fruits ? L'hydrolyse du glycoside peut libérer de l'acide cyanhydrique, la réaction étant renversable. HCN est un poison Citer deux méthodes employées par les chimistes pour protéger, ou bloquer une fonction alcool ou phénol en synthèse. - Formation d'un ester. - Formation d'un acétal avec le dihydropyrane. |
||||
|
|
||||
|
|