|
Dosage du saccharose dans une sève d'érable ; détermination de l'adultération d'un sirop d'érable par SMRI concours agrégation 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
|
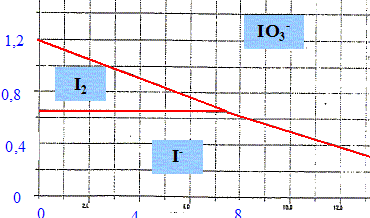
Indications : L'hydrolyse acide d'une mole de saccharose C12H22O11 libère une mole de glucose C6H12O6 et une mole de fructose C6H12O6. Le glucose, de formule HOCH2-(CHOH)4-CHO sous sa forme ouverte, possède une fonction aldehyde à caracteur réducteur. On le notera sous la forme générique R-CHO. Il a un goût sucré. Le fructose, de formule HOCH2-CO-(CHOH)3-CH2OH possède une fonction cétone. Il a un goût très sucré. Dosage du saccharose dans une sève d'érable. On souhaite doser le saccharose dans une sève d'érable assimilée à une simple solution aqueuse de saccharose. Protocole expérimental : Hydrolyse du sacharose en milieu acide : Dans un ballon de 150 mL, introduire V1 = 20,0 mL de la solution S1, de concentration c1 de saccharose ( sève) et 5 mL de solution d'acide chlorhydrique à 2 mol/L. Chauffer à doux reflux pendant 20 min. Refroidir et ajuster le pH à 8 en versant doucement une solution de soude à 2 mol/L Transvaser dans une fiole jaugée de volume V2 = 50,0 mL et ajuster. Bien agiter. La solution obtenue est notée S2. Dosage du glucose libéré : Dans un erlenmeyer rodé, introduire V3 = 20,0 mL de solution S2, V4=20,0 mL d'une solution de diiode de concentration C4=5,00 10-2 mol/L et 5 mL d'une solution de soude à 2 mol/L. Boucher, agiter et laisser reposer 30 min à l'obscurité. Ajouter alors 10 mL d'acide chlorhydrique à 2 mol/L. On dose ensuite de diiode par une solution de thiosulfate de sodium à C5=1,00 10-1 mol/L. Le volume versé à l'équivalence est V5=15,2 mL. On donne le diagramme E-pH de l'iode tracé pour une concentration totale en élément iode dissous C=0,1 mol/L, avec équirépartition de l'élément à la frontière.
Ecrire l'équation de la réaction d'hydrolyse du saccharose. C12H22O11 + H2O = HOCH2-(CHOH)4-CHO + HOCH2-CO-(CHOH)3-CH2OH Que subit le diiode en milieu basique. Ecrire l'équation de la réaction ? dismutation du diiode : I2/I- : 5I2+ 10e- = 10I- . Le diiode joue le rôle d'oxydant qui se réduit. IO3-/I2 : I2+ 12HO- = 2IO3- +10e- + 6H2O. Le diiode joue le rôle de réducteur qui s'oxyde. 6I2+12HO- = 2IO3- +10I- + 6H2O. Ecrire l'équation de la réaction d'oxydation du glucose. En milieu basique ( pH=8) : l'oxydant est IO3-. IO3-/I- : IO3- +6e- + 3H2O =I-+ 6HO- . RCOO- / RCHO : { RCHO + 3HO- = RCOO- + 2H2O + 2e-} 3 fois IO3- +3 RCHO + 3HO- = I-+3 RCOO- + 3H2O.
Rétrodismutation
des ions IO3-
excédentaires afin d'obtenir du diiode que
l'on sait doser. IO3-
excès
+
5I- + 6 H+= 3I2 +
3H2O Ecrire l'équation de la dernière étape du dosage avec le thiosulfate de sodium et calculer sa constante d'équilibre. couple I2/I- : E° = 0,62 V ; couple S4O62-/ S2O32- : E°= 0,09 V I2 +2e- = 2I-. E1 = 0,62 + 0,03 log([I2] /[I-]2) 2 S2O32- =S4O62-+2e-. E2 = 0,09 + 0,03 log([S4O62-]/[S2O32-]2) I2 +2 S2O32- =S4O62-+2I-. K= [S4O62-] /[I-]2 / ([S2O32-]2[I2]) à l'équilibre E1 = E2. 0,62 + 0,03 log([I2] /[I-]2) = 0,09 + 0,03 log([S4O62-]/[S2O32-]2) (0,62-0,09)/0,03 =log ([S4O62-][I-]2/[S2O32-]2[I2]) = log K log K = 17,7 ; K = 4,6 1017. Donner la définition de l'équivalence. Comment la repérer ? A l'équivalence les quantités de matières des réactifs mis en présence sont en proportions stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès ; après l'équivalence, l'autre réactif est en excès. L'empois d'amidon ou le thiodène donne une couleur bleue en présence de diiode : à l'équivalence la coloration bleue disparaît. Certaines données du protocole présentes 3 chiffres significatifs, d'autres n'en présentent qu'un seul. Justifier. Les données concernant un dosage doivent être très précises ; celles concernant l'ajustement du pH n'ont pas besoin de grande précision. Calculer la concentration c1 de la sève en saccharose. La concentration en saccharose est égale à la concentration initiale en glucose. 3I2+6HO- =IO3- +5I- +3H2O. n(IO3-)initial = n(I2)initial / 3 = c4V4/3 = 5,00 10-2 * 20,0 10-3/3 =3,333 10-4 mol IO3- +3 RCHO + 3HO- = I-+3 RCOO- + 3H2O. n(glucose) = 3 n(IO3-) IO3- excès + 5I- + 6 H+= 3I2 + 3H2O n(IO3-)excès = n(I2)/3 I2 +2 S2O32- =S4O62-+2I-. n(I2) = ½n(S2O32-) = ½ c5V5 = 1,00 10-1 * 15,2 10-3/2 =7,60 10-4 mol d'où n(IO3-)excès =7,60 10-4 / 3 = 2,533 10-4 mol n(IO3-) ayant réagi avec le glucose : 3,333 10-4 - 2,533 10-4 = 8,00 10-5 mol. n(glucose) = 3 n(IO3-) = 3*8,00 10-5 =2,40 10-4 mol dans un volume de 20,0 mL de S2. soit 2,40 10-4* V2/V3 = 2,40 10-4 * 50/20 = 6,0 10-4 mol [glucose] = 6,00 10-4/ 20,0 10-3 =3,00 10-2 mol/L. [saccharose] = 3,00 10-2 mol/L ou 3,00 10-2 *342 = 10,3 g/L.
Détermination de l'adultération d'un sirop d'érable par SMRI. Une fraude très répandue consiste à diluer le sirop d'érable par un sirop produit par hydrolyse partielle du sucre de canne. On peut lire dans la revue " journal of AOAC internationnal vol 87,2004" : " si les sucres ajoutés sont au même taux d'inversion que le sirop original, alors seule une méthode isotopique permet de les détecter". Les normes d'authencité actuelles reposent sur la spectrométrie de masse de rapport isotopique ( acronyme SMRI). Elles permettent de détecter le rapport, noté R, des quantités de matière 13C/12C dans le dioxyde de carbone obtenu par combustion de l'éthanol, lui même obtenu par fermentation puis distillation du jus sucré. Cette méthode permet de déterminer la déviation isotopique du carbone, noté d13C, selon la formule : d13C( en %o) = 103(R-Rref)/Rref. Quel est le double intérêt des fraudeurs ? Le sucre de canne est bon marché ; le mélange a un goût plus sucré que le sirop d'érable non trafiqué. Pourquoi l'article parle t-il d'inversion ? Lors de l'hydrolyse du saccharose, le pouvoir rotatoire de la solution change de signe.
a = [a]l l C a : pouvoir rotatoire ( degré) ; l épaisseur de substance ( dm) ; C : concentration en substance dissoute ( g/mL) [a]l : pouvoir rotatoire spécifique. initial : a0 = [a]saccharose l C Msaccharose= 65 *342 C ( valeur positive). final : afin = [a]fructose l C Mfructose + [a]glucose l C Mglucose afin = (-92 + 52,2) *180 C = -39,8*180 C ( valeur négative) Calculer le taux d'inversion ? Lorsque le pouvoir rotatoire change de signe ( il y a inversion), a=0. [a]saccharose l (C-xinv) Msaccharose+ [a]fructose l xinv Mfructose + [a]glucose l xinv Mglucose =0 65*342 (C-xinv) -39,8*180 xinv=0 22230 C = 29394 xinv ; xinv /C = 0,76. Ecrire l'équation de fermentation anaérobique du glucose en éthanol. C6H12O6 = 2 CO2 + 2C2H5OH. La distillation fractionnée du produit de fermentation permet-elle d'isoler l'éthanol pur ? Le produit de cette distillation est un azéotrope, mélange eau éthanol : tout l'alcool se retrouve dans le distillat. Définir isotope. Citer un isotope stable et un isotope instable de 12C. Citer une autre utilisation de l'existence de chacun de ces isotopes. Des isotopes ne diffèrent que par leur nombre de neutrons. 12C instable : utilisé dans les datations d'objets anciens ; 13C stable, utilisé en RMN.
Expliquer brièvement le principe de la spectrométrie de masse. Après ionisation et fragmentation d'une molécule, la spectrométrie de masse permet son indification. Les ions obtenus sont séparés en fonction du rapport masse / charge par des champs électrique et magnétique. C'est une technique d'analyse qualitative et quantitative. Quel est l'ordre de grandeur du rapport 13C/12C dans la nature ? environ 1%. Comment interpréter le signe négatif dans les valeurs données ci-dessous ?
Rref> R Comment a t-on choisi la référence étalon ? La référence est très riche en
13C.
Quel est le sucre apporté par les fraudeurs ? La valeur d13C augmente, si on ajoute au sirop d'érable du sucre de canne. Quel est le pourcentage massique minimal en sucre ajouté ? On note n la proportion massique de sucre de canne ajouté. d13Ctrafiqué = n d13Ccanne + (1-n)d13C érable. -20,6 = -12,5 n + (1-n)(-23) 23-20,6 = (23-12,5) n ; n = 0,23. ( 23 %) Valeur minimale, car on a pu ajouter un mélange de sucre de canne et de betterave ; ce dernier compensant, du point de vue de la SMRI, le sucre de canne ajouté. |
||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||
|
|