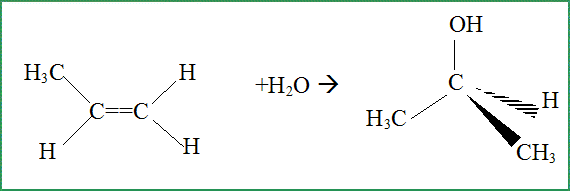|
Propriétés du propan-2-ol ou isopropanol BTS cosmétique esthétique 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||
|
||||||
|
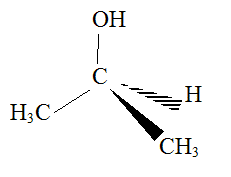
Il entre notamment dans la composition de lotions astringentes, c'est à dire ayant des propriétés de resserer les tissus. Propriétés structurelles : En utilisant la méthode VSEPR, déterminer, en justifiant, la géométrie de la molécule de propan-2-ol. On considère comme atome central celui qui porte le groupe caractéristique. L'atome central est un atome de carbone comportant quatre électrons externes ( de valence) et aucun doublet non liant. Cet atome de carbone établit quatre liaisons de covalence simples. D'où le type AX4 et la structure tétaédrique :
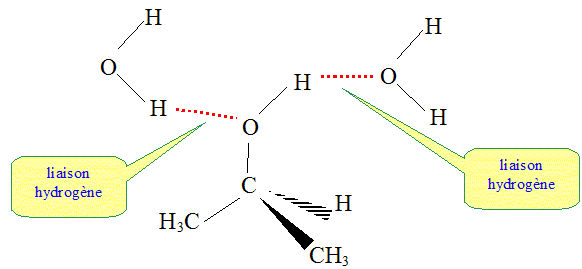
On donne les électronégativités des atomes de carboen : 2,5 ; d'hydrogène : 2,2 ; d'oxygène : 3,5. Comment qualifier la liaison O-H dans la molécule d'isopropanol ? Les électronégativités des atomes d'oxygène et d'hydrogène sont très différentes. Le doublet de liaison est plus proche de l'oxygène que de l'hydrogène. La liaison O-H est polarisée. Comment qualifier les différentes liaisons dans la molécule de propane ? Dans cette molécules il y a des liaison carbone carbone et carbone hydrogène. Or les deux atomes de carbone et d'hydrogène ont des électronégativités proches. Les différentes liaisons dans la molécule de propane ne sont pas polarisées. En déduire pourquoi le propane est très peu soluble dans l'eau, alors que le propa-2-ol y est très soluble. La molécule d'eau H2O est une molécule polaire. En conséquence les molécules possédant des liaisons polarisées seront solubles dans un solvant polaire comme l'eau ( liaisons hydrogène entre solvant et molécule polaire). Par contre une molécule non polaire, comme le propane, ne sera pas soluble dans un solvant polaire.
Propriétés réactionnelles : Il est possible d'obtenir le propan-2-ol par hydratation du propène. Ecrire l'équation associée à la réaction chimique.
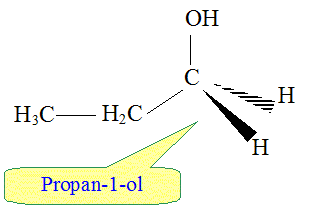
On obtient aussi en faible quantité, un autre produit. Le nommer et donner sa formule semi-développée.
Comment qualifie t-on les produits obtenus ? En donner une définition. Isomères : même formule brute mais des formules spatiales ( semi-développées) diférentes.
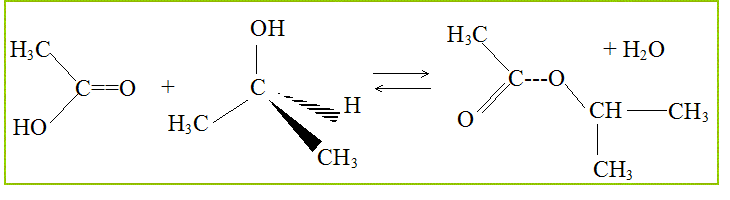
On peut faire réagir le propan-2-ol avec l'acide éthanoïque ( ou acétique) Nommer cette réaction. estérification. Quelles sont ces principales caractéristiques ? lente, athermique, limitée par l'hydrolyse de l'ester. Ecrire l'équation associée à cette réaction chimique.
Quel est le nucléophile ? Le nucléophile, ami des noyaux, est un atome riche en électrons, l'atome d'oxygène de la fonction alcool.
On peut aussi faire réagir le propan-2-ol avec le dichromate de potassium en solution aqueuse acide diluée. De quel type de réaction s'agit-il ? Oxydoréduction. Les couples oxydant / réducteurs mis en jeu sont : Cr2O72- /Cr3+ et C3H6 O / C3 H8 O Ecrire les demi-équations correspondant à chaque couple ainsi que l'équation traduisant le bilan ? 3 fois{ C3 H8 O = C3H6 O + 2 électrons + 2H+}. Cr2O72- + 6 electrons +14 H+ = 2 Cr3+ + 7 H2O 3 C3 H8 O + Cr2O72- +14 H+ donne 3 C3H6 O + 2 Cr3+ + 6 H+ + 7 H2O Peut-on continuer la réaction pour obtenir un autre produit ? Si oui lequel ? Non : dans ces conditions, la propanone obtenue, une cétone, ne s'oxyde pas. |
||||||
|
|
||||||
|
|