|
Pile fer cuivre : bts bâtiment 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||
| .
. |
||||
|
||||
|
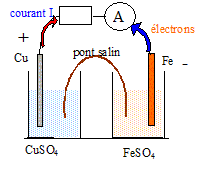
Mathieu, grand consommateur de piles électriques, s'interroge sur leur fonctionnement. Pour réaliser une pile on associe une demi-pile fprmée d'une électrode de cuivre plongeant dans une solution de sulfate de cuivre II et une demi-pile formée d'une électrode de fer plongeant dans une solution de sulfate de fer II. Les solutions ont des concentrations égales à 1 mol/L. Les deux compartiments sont reliés par un pont salin ; cette pile débite dans un circuit extérieur constitué par une résistance et un ampèremètre en série. Faire le schéma du montage. Déterminer la polarité des électrodes. données : E(Cu2+/Cu )= 0,34 V ; E(Fe2+/Cu )= -0,44 V
Le métal le plus électronégatif, le fer, ( potentiel E le plus faible) s'oxyde en libérant des électrons : il constitue le pôle négatif de la pile. Calculer la valeur de la force électromotrice. E= E(Cu2+/Cu ) -E(Fe2+/Cu )= 0,34- (-0,44)=0,78 V. Quelle est la nature des réactions aux électrodes ? Ecrire les demi-équations électroniques puis le bilan. anode négative : oxydation du fer en ion fer II Fe(s) = Fe2+ + 2e-. cathode positive : réduction de Cu2+ en cuivre métal. Cu2+ + 2e-= Cu (s)
On laisse
fonctionner la pile pendant deux heures :
on constate que la
masse de l'électrode de cuivre a
augmenté de 25 mg. Calculer la diminution de masse de l'électrode de fer. Données : M(Cu) = 63,5 g/mol ; M(Fe) = 55,8 g/mol) Quantité de matière (mol) = masse (g) / masse molaire (g/mol). Quantité de matière de cuivre n(Cu) = m / M(Cu) n(Cu) = 25 10-3 / 63,5 =3,94 10-4 mol. Cu2+ +Fe(s) = Fe2+ +Cu (s) D'après les nombres stoechiométriques de cette équation : n(Fe) = n(Cu) =3,94 10-4 mol. masse (g) = quantité de matière (mol) * masse molaire (g/mol). masse de fer = n(Fe) *M(fe) = 3,94 10-4 *55,8 =21,96 10-2 g = 22 mg.
Calculer l'intensité du courant constant qui a circulé. Cu2+ + 2e-= Cu (s). D'après les nombres stoechiométriques de cette équation : n(e-) = 2 n(Cu) = 2 * 3,94 10-4 = 7,87 10-4 mol. Or la charge électrique, en valeur absolue, d'une mole d'électrons vaut 96500 coulombs. Quantité d'électricité ayant traversé le circuit : Q = 96500*7,87 10-4 =76 C. Quantité d'électricité (C) = intensité (A) * durée ( s). intensité I = Q / Dt = 76 / (2*3600) =1,055 10-2 A = 1,1 10-2 A = 11 mA.
|
||||
|
|
||||
|
|