|
Corrosion et protection des métaux bac Amérique du sud 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
Pour comprendre ce phénomène, un professeur de chimie propose à ses élèves de réaliser quelques expériences simples. Pour commencer, les élèves effectuent en tubes à essai, des tests caractéristiques dont les résultats sont rassemblés dans te tableau suivant :
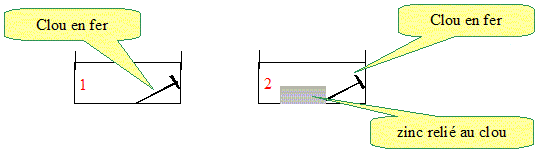
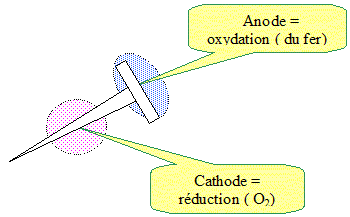
Ils préparent à chaud un mélange d'eau salée, de solution aqueuse d'hexacyanoferrate III de potassium, de phénolphtaléïne et de gélifiant. Ils versent ce mélange dans les deux boîtes de Pétri et laissent refroidir une heure jusqu'à ce que le gel fige. Exploitation de l'expérience réalisée dans la boîte de Pétri (1). On observe que les parties extrêmes du clou (pointe et tête) sont entourées d'une zone bleue alors que la partie centrale est entourée d'une zone rose. Quels sont les ions apparus dans les parties extrêmes et dans la partie centrale du clou ? parties extrèmes bleues : mise en évidence des ions fer II Fe2+ aq. zone centrale rose : mise en évidence des ions HO-aq. Écrire la demi-équation électronique traduisant la transformation du métal fer aux extrémités du clou. oxydation du fer : 2Fe(s) = 2Fe2+aq + 4e-. La demi-équation électronique traduisant la transformation qui a lieu dans la partie centrale du clou s'écrit : O2 (dissous) + 2 H2O (l) + 4 e - = 4 HO - (aq). En déduire l'équation de la réaction d'oxydoréduction modélisant la transformation chimique se produisant à la surface du clou. additionner les deux demi-équations électroniques. O2 (dissous) + 2 H2O (l) +2Fe(s)= 4 HO - (aq) +2Fe2+aq. Pour interpréter les observations faites dans la boîte de Pétri (1), on suppose que le clou se comporte comme une micropile, puisque l'oxydation et la réduction se produisent dans des zones distinctes (pour simplifier, on étudiera la partie centrale et une seule des deux extrémités). Comme dans toute pile classique, l'électroneutralité du milieu est assurée par le déplacement des ions, ici dans le gel salin. Compléter la figure en indiquant : - Les zones d'oxydation et de réduction. - Les zones anodique et cathodique.
Le clou est entouré quasi uniformément d'une zone rose alors que la lame de zinc est entourée d'une zone blanche. Quel est, des deux métaux, celui qui est oxydé ? Justifier. zone blanche autour du zinc : mise en évidence des ions zinc II Zn2+ aq. Le zinc s'oxyde (Zn(s) = Zn2+aq + 2e-) et constitue une anode "soluble". zone rose autour du clou : mise en évidence des ions HO-aq. Utiliser les résultats de cette expérience pour expliquer pourquoi les constructeurs de bateaux fixent des blocs de zinc sur la coque en acier des navires. Le zinc s'oxyde ( à la place du fer) et protège la coque en fer tant qu'il y à présence de bloc de zinc. Un marin veut s'assurer de la bonne protection de la coque de son bateau par ce procédé. Pour cela, il branche un voltmètre, en mode continu, entre la coque en acier et le bloc de zinc. La borne COM du voltmètre étant relié à la coque en acier et la borne V au bloc de zinc, le voltmètre indique - 320 mV. En admettant que l'association {coque en acier, eau de mer, bloc de zinc} forme une pile, déduire de cette mesure les polarités de cette pile. La protection est-elle assurée ? Justifier. Le voltmètre indique une valeur négative. Il est branché à l'envers : La borne COM est reliée à la borne positive de la pile ; la borne V est reliée à la borne négative de la pile. L'acier de la coque constitue la borne positive de la pile. L'acier joue donc le rôle de cathode ; à la cathode se produit une réaction de réduction. Le zinc constitue la borne négative de la pile. Le zinc joue le rôle d'anode ; à l'anode se produit une réaction d'oxydation. Le zinc s'oxyde et protège le fer de la coque.
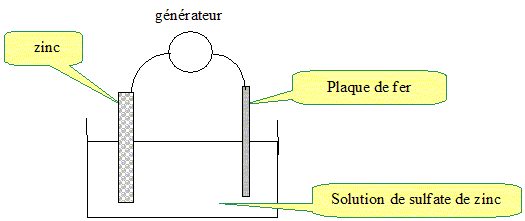
Protection par revêtement métallique : Electrozincage. L'un des procédés utilisé pour protéger l'acier de la corrosion est de l'isoler de l'atmosphère en le recouvrant d'un revêtement métallique. Des plaques d'acier sont ainsi recouvertes d'une fine couche de zinc, on dit qu'elles sont " galvanisées ". Pour cela, on procède à l'électrolyse d'une solution aqueuse de sulfate de zinc (II) (Zn2+(aq) + SO42-(aq)). Dans ce bain électrolytique, on plonge une plaque à recouvrir et on utilise une lame de zinc comme seconde électrode. Compléter le schéma suivant en indiquant :
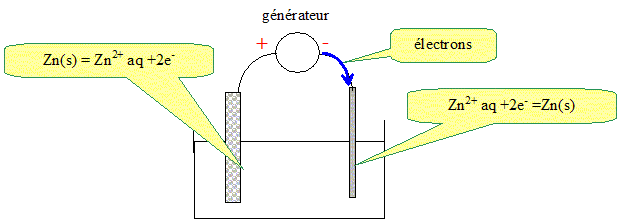
- où se forme le dépôt de zinc : Le zinc doit recouvrir le fer afin de le protéger : le zinc se dépose sur le fer. - la demi équation électronique traduisant la transformation ayant lieu sur la plaque de fer : Réduction des ions Zn2+aq au niveau du fer : Zn2+aq +2e- = Zn(s). - le sens de déplacement des électrons dans les conducteurs métalliques : La réduction des ions Zn2+aq nécessite un apport d'électrons de la part du générateur. Les électrons se déplacent dans les conducteurs métalliques du générateur vers le fer. - les polarités du générateur : Le fer es relié à la borne négative du générateur. - la demi équation électronique traduisant la transformation ayant lieu sur la lame de zinc : La lame de zinc reliée à la borne positive du générateur est une anode : elle subit une oxydation : Zn(s) =Zn2+aq +2e- .
La plaque d'acier a une surface totale de 10 m². On veut déposer une couche de zinc de 0,10 mm d'épaisseur, ce qui correspond à un volume de zinc égal à V= 1,0 103 cm3. L'intensité du courant est maintenue constante et égale à I= 1,0 kA.
Données : masse volumique du zinc : r = 7,14 g.cm-3 ; masse molaire du zinc : M = 65,4 g. mol-1 Constante d'Avogadro : NA = 6,02 1023 mol-1 ; charge élémentaire : e = 1,60 10 -19 C ; Faraday : F = 96500 C mol -1 Calculer la masse de zinc à déposer. masse (g) = volume (cm3) * masse volumique g cm-3) m = Vr m = 1,0 103 *7,14 = 7,14 103 g = 7,1 103 g. En déduire la quantité d'électrons (en mol) devant traverser le circuit. Quantité de matière (mol) de zinc = masse (g) / masse molaire (g/mol) n= m/M n = 7,14 103 /65,4 =109,17 mol Zn2+aq +2e- = Zn(s). La quantité de matière d'électrons est égale à deux fois la quantité de matière de zinc. n(e-) = 2*109,17 = 218,35 mol = 2,2 102 mol. En déduire la durée de l'électrolyse. Quantité d'électricité (coulomb) Q= n(e-) F = 218,35*96500 =2,107 107 C De plus Q= It avec I en ampère et t en seconde t = Q/I = 2,107 107 /1,0 103 = 2,1 104 s.
|
||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||
|
|