|
Fabrication d'un savon, eau oxygénée, statique des fluides bac SMS 2007 |
||||
|
||||
|
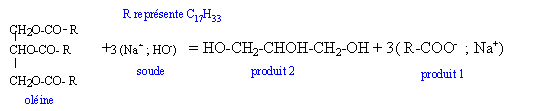
La composition d'une savonnette montre la présence de nombreux ingrédients dont l'oléate de sodium (produit 1). La fabrication d'oléate de sodium est très lente à température ambiante. Au laboratoire, pour l'effectuer, on réalise un montage à reflux. L'équation correspondant à cette réaction est :
Etude théorique
Le manipulateur a effectué la réaction évoquée en utilisant 8,84 g d'oléine. M ( Oléine ) = 884 g.mol-1 ; M ( Oléate de sodium ) = 304 g.mol-1.
Etude théorique : Réaction de saponification d'un triester, réaction totale. Un triglycéride est un triester du glycérol et d'un acide gras. Le "produit 2" est le glycérol, molécule possédant trois fonctions alcool. La formule de l'acide oléique est C17H33-COOH ou C18H34O2. Un acide gras saturé comptant 18 atomes de carbone possède 36 atomes d'hydrogène ; l'acide oléique n'en possédant que 34 sera insaturé. Etude théorique : Quantité de matière (mol) = masse (g) / masse molaire ( g/mol) n0 = 8,84 / 884 = 0,01 mol. D'après les nombres stoechiométriques de l'équation de la réaction, à partir d'une mole de glycéride on obtient 3 moles de savon. A partir de 0,01 mol de triglycéride on obtient nS=0,03 mol de savon. Masse (g) = masse molaire (g/mol) * quantité de matière (mol) m = 304*0,03 = 9,1 g.
(6 points) Pour nettoyer une petite plaie une infirmière doit utiliser de l'eau oxygénée dont le titre est 10 volumes.
Le titre en volumes d'une eau oxygénée est égal au volume de dioxygène libéré par 1 L de solution d'eau oxygénée, le volume de dioxygène étant mesuré dans les conditions normales de température et de pression. Le facteur de dilution est égal à 10. Le volume de solution mère est dix fois plus petit que le volume de la solution fille. Vmère = Vfille/ 10 = 10 mL. La solution mère est prélevée à l'aide d'une pipette jaugée de 10 mL + pipeteur ; on utilisera une fiole jaugée de 100 mL. Quantité de matière (mol) = volume (L) * concentration (mol/L) n2 = V2C2 = 16 10-3 * 0,20 = 3,2 10-3 mol. D'après les nombres stoechiométriques de l'équation du dosage, 1 mol d'ion permanganate réagi avec 2,5 mol d'eau oxygénée. A l'équivalence, la quantité de matière d'eau oxygénée est 2,5 fois plus grande que celle d'ion permanganate. n1 =2,5 n2. C1= 2,5 C2V2/V1 = 2,5*16 10-3 * 0,20 / 10 10-3= 0,8 mol/L. Le titre de la solution fille vaut : H2O2 = H2O + ½O2. A partir de 1 L d'eau oxygénée à 0,8 mol on obtient 0,4 mol de dioxygène. Volume d'un gaz ( L) = quantité de matière (mol) * volume molaire ( L/mol) = 0,4*22,4 = 9 L. La solution fille titre 9 volumes.
Lors d'un dosage, on a utilisé une burette graduée remplie de permanganate de potassium représentée ci-dessous. La hauteur séparant A (partie supérieure) et B (partie inférieure) est h = 60 cm (60 cm = 0,60 m). La pression en A est la pression atmosphérique : pA = 1,02 105 Pa.
force ( N) = pression (Pa) * surface (m2). F= pASA =1,02 105 * 5,03 10-5 =1,02*5,03 = 5,13 N. r est une masse volumique exprimée en kg m-3. Dp = r.g.h = 1080*9,81 *0,60 =6,4 103 Pa. pB = Dp +pA =6,4 103 + 1,02 105 = 1,08 105 Pa. |
||||
|
|
||||
|
|