|
cinétique :
titrage avec une réaction lente,
spectrophotométrie
bac Polynésie
09/07 |
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
Pour cela on se propose d'étudier la réaction entre les ions iodure I- et le peroxyde d'hydrogène H2O2 en milieu acide. Cette réaction est lente et totale. Ces deux espèces chimiques appartiennent aux couples oxydant / réducteur I2 aq / I- aq et H2O2 (l) / H2O(l). Parmi ces espèces seul le diiode est coloré (jaune) en solution aqueuse. L'étude de la cinétique se fait par spectrophotométrie. Etude de la réaction d'oxydoréduction et préparation de la solution Ecrire les deux demi-équations d'oxydoréduction des deux couples étudiés : 2 I- (aq) = I2 (aq) + 2e- oxydation H2O2 (l) + 2H+ +2e- = 2H2O(l) réduction Par déduction la réaction entre ces deux couples a pour équation : H2O2 (l) + 2H+ +2 I- (aq) = I2 (aq) +2H2O(l) Comment évolue la coloration de la solution au cours du temps ? Seul le diiode est coloré (jaune) ; initialement le diiode n'est pas présent ; la concentration en diiode augmente au cours du temps. La coloration
passe de l'incolore au
jaune.
Donner les principales étapes du protocole opératoire afin de préparer V2 = 50 mL d'une solution d'eau oxygénée de concentration c2 = ccom /10. Le facteur de dilution vaut F= 10. 10 = volume de la fiole jaugée / volume de la pipette jaugée = 50 / volume de la pipette jaugée volume de la pipette jaugée = 50/10 = 5,0 mL Prélever 5,0 mL de solution commerciale à l'aide d'une pipette jaugée. Placer dans une fiole jaugée de 50 mL. Compléter avec de l'eau distilée jusqu'au trait de jauge. Agiter pour rendre homogène.
Etude d'une transformation par spectrophotométrie On utilise le spectrophotomètre pour réaliser la mesure de l'absorbance d'une solution aqueuse de diiode de concentration c0 = 1,0 10-2 mol/L. On mesure alors une absorbance A0 = 0,60. Sachant que l'absorbance A est proportionnelle à la concentration en diiode, déterminer le coefficient de proportionnalité k. A0 = k c0 ; k = A0 /c0 = 0,60 / 0,010 = 60 L mol-1. A une date t=0, on mélange dans un bécher une solution d'iodure de potassium de volume V1 = 25 mL de concentration c1 = 5,0 10-2 mol/L et acidifiée ( les ions oxonium seront considérés en large excès) à une solution d'eau oxygénée de volume V2 = 50 mL et de concentration inconnue c2. On verse alors rapidement un faible volume ( négligeable devant V1 et V2) de ce mélange réactionnel dans une cuve qu'on introduit dans le spectrophotomètre. Etablir le tableau d'avancement.
[I2]= x / (V1+V2) = x/0,075 En déduire la relation littérale entre l'absorbance A et l'avancement x de la réaction étudiée. A = k [I2] = k x/(V1+V2) = 60x/0,075 = 8,0 102 x. Hypothèse : l'iodure de potassium est le réactif en défaut. quelle valeur numérique l'avancement devrait-il prendre lorsque le système chimique atteindra son état final ? 1,25 10-3-2xmax = 0 donne xmax = 1,25 10-3/2 = 6,2 10-4 mol ( 6,25 10-4 ) En déduire la valeur finale de l 'absorbance. Amax = 8,0 102 xmax =800*6,25 10-4 = 0,50.
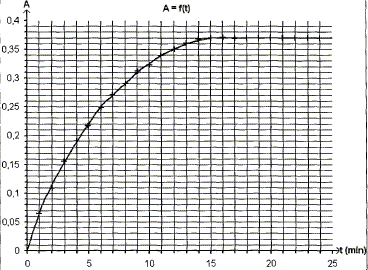
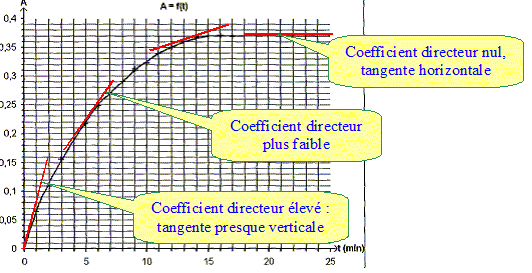
Le spectrophotomètre est relié à un ordinateur qui trace la courbe représentant l'absorbance au cours du temps, le résultat est ci-dessus : Donner l'expression de la vitesse volumique de réaction v en fonction de V1, V2 et x. v = 1/(V1+V2) dx/dt. Montrer qu'elle peut se mettre sous la forme v=1/k dA/dt. Or A = k [I2] = k x/(V1+V2) ; x = A(V1+V2) / k dx/dt = (V1+V2) / k dA/dt ; d'où v = 1/k dA/dt. A partir de la courbe dire comment évolue v au cours du temps. dA/dt correspond au coefficient directeur de la tangente à la courbe A=f(t) à une date donnée.
La vitesse est proportionnelle à dA/dt. dA/dt diminue au cours du temps ; la vitesse diminue au cours du temps. Interpréter cette évolution. La concentration des réactifs est un facteur cinétique ; au cours du temps la concentration des réactifs diminue et en conséquence la vitesse décroît. Expliquer pourquoi on peut considérer qu'au bout de 15 min , le système atteint son état final. La tangente à la courbe étant horizontale, la vitesse de la réaction est nulle. La composition du mélange ne change plus. L'état final est atteint.
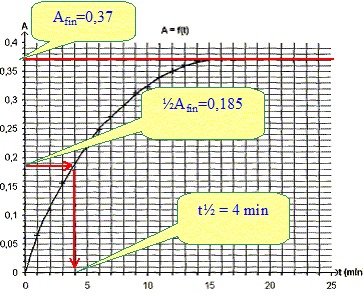
Déterminer après l'avoir défini le temps de demi réaction t½. C'est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final. Or ici avancement et absorbance sont proportionnels : à t½ l'absorbance est égale à la moitié de l'absorbance finale
La valeur finale de l'absorbance est inférieure à la valeur trouvée ci-dessus. A partir de la valeur prise par l'absorbance dans l'état final, montrer que l'avancement maximale est xmax = 4,6 10-4 mol. Afin = 0,37 et de plus A= 8,0 102 x. 0,37 = 800 xmax soit xmax = 0,37/800 = 4,6 10-4 mol. L'hypothèse faite ci-dessus est-elle correcte ? Hypothèse fausse : "l'iodure de potassium est le réactif en défaut ". C'est l'eau oxygénée qui est le réactif en défaut. Déterminer la valeur de c2, en déduire celle de ccom. V2c2 = xmax ; c2 = xmax /V2 = 4,6 10-4 / 0,05 = 9,2 10-3 mol/L ccom = 10 c2 = 9,2 10-2 mol/L La réaction étudiée a-t-elle toutes les caractéristiques d'une réaction de titrage ? "Cette réaction est lente et totale" Une réaction support d'un titrage doit être totale et rapide. La réaction étudiée n'a pas les caractéristiques requises pour un titrage. |
||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||
|
|