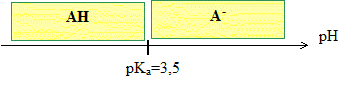|
Etude de médicaments à base d'aspirine bac Nlle Calédonie 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||
|
||||||
|
L'acide acétylsalicylique, ou aspirine, est le médicament le plus vendu dans le monde. Cependant, la prise d'aspirine n'est pas sans danger, elle peut provoquer des ulcères à l'estomac ou être à l'origine de saignements. C'est afin de limiter ces risques que ce médicament se présente sous différentes formulations. On se propose dans cet exercice d'en étudier deux : l'aspirine simple et l'aspirine pH8.
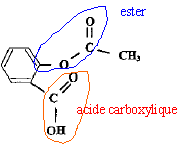
L'acide acétylsalicylique sera noté AH et l'ion acétylsalicylate A-. La forme AH est liposoluble tandis que la forme A- est hydrosoluble. La muqueuse de l'estomac (muqueuse gastrique) présente des lipides au niveau de ses tissus. Masse molaire : M(acide acétylsalicylique ) = 180 g.mol-1. pKa du couple acide acétylsalicylique / ion acétylsalicylate (AH / A-) : 3,5 à la température de l'étude expérimentale. pH estomac = 2 ; pH intestin = 8. D'après la notice de l'aspirine simple : COMPOSITION : Acide acétylsalicylique ..................…...... 500 mg Excipients : Amidon de maïs, poudre de cellulose granulée FORME PHARMACEUTIQUE : Comprimés CLASSE PHARMACOTHÉRAPEUTIQUE : Antalgique périphérique, antipyrétique MODE ET VOIE D'ADMINISTRATION : Voie orale. Boire immédiatement après dispersion complète des comprimés dans un grand verre d'eau, de préférence au moment des repas. D'après la notice de l'aspirine pH8 : COMPOSITION QUALITATIVE : Acide acétylsalicylique ……………………...500 mg Excipients : Amidon de riz, acétophtalate cellulose, phtalate d'éthyle FORME PHARMACEUTIQUE : Comprimé gastro-résistant CLASSE PHARMACOTHÉRAPEUTIQUE : Antalgique périphérique, antipyrétique, anti-inflammatoire à dose élevée, antiagrégant plaquettaire MODE ET VOIE D'ADMINISTRATION : Voie orale. Les comprimés sont à avaler tels quels avec une boisson (par exemple eau, lait, jus de fruits). Questions préliminaires. Recopier la formule de l'aspirine et préciser, après les avoir encadrés, le nom des groupes caractéristiques (ou fonctionnels) qu'elle contient.
Tracer le diagramme de prédominance des espèces chimiques du couple AH /A - .
Sous quelle forme, AH ou A-, l'organisme assimile-t-il l'aspirine dans l'estomac et dans l'intestin ? Le pH de l'estomac est pH=2 : à pH inférieur à pKa, la forme acide AH prédomine. Le pH de l'intestin est pH=8 : à pH supérieur à pKa, la forne base A- prédomine. Pourquoi l'aspirine
simple est-elle absorbée par la muqueuse
gastrique
? La forme AH est
liposoluble. La muqueuse de l'estomac (muqueuse gastrique)
présente des
lipides
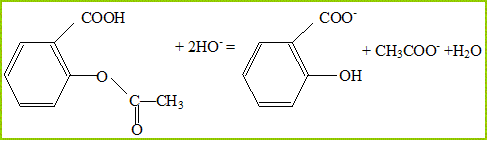
au niveau de ses tissus. Justifier le mode d'administration de cette formulation d'aspirine décrit dans le texte. "Boire immédiatement après dispersion complète des comprimés dans un grand verre d'eau, de préférence au moment des repas". L'aspirine peut provoquer des brûlures d'etomac si elle est prise en dehors des repas. Afin de vérifier l'indication " 500 mg " de la notice, on saponifie l'aspirine par un excès de soude et on dose cet excès par une solution d'acide chlorhydrique. Le protocole opératoire est le suivant : Introduire dans un ballon un comprimé d'aspirine simple, 10 mL d'eau distillée, 10,0 mL de solution de soude de concentration molaire cB = 1,0 mol.L-1 et quelques grains de pierre ponce. Chauffer le mélange à reflux pendant une vingtaine de minutes. Verser le contenu refroidi du ballon dans une fiole jaugée de 100,0 mL, récupérer l'eau de rinçage et compléter le niveau au trait de jauge avec de l'eau distillée. Doser alors 10,0 mL de cette solution par une solution d'acide chlorhydrique de concentration molaire cA = 5,0 10-2 mol.L-1 en présence de phénolphtaléine. Expérimentalement, le volume équivalent d'acide versé vaut : VAE = 8,4 mL. On modélise la transformation chimique ayant lieu avant le dosage par la réaction dont l'équation s'écrit :
L'indicateur coloré choisi permet de ne doser que la base HO - présente dans le milieu. L'équation support du dosage s'écrit : H3O+ (aq) + HO - (aq) = 2 H2O ( l ) Calculer la quantité de matière ni (HO - ) d'ions hydroxyde introduits dans le ballon. quantité de matière (mol) = volume (L) * concentration (mol/L) ni (HO - ) = 10 10-3 * 1,0 = 1,0 10-2 mol. Déduire du volume équivalent versé, la quantité de matière n d'ions hydroxyde en excès présente dans le prélèvement de 10,0 mL. A l'équivalence les quantités de matière des réactifs sont en proportions stoechiomètriques : n = cA VAE = 5,0 10-2 *8,4 10-3 = 4,2 10-4 mol. Calculer la quantité de matière n' d'ions hydroxyde en excès présente dans les 100,0 mL de départ. Soit n'= 4,2 10-3 mol dans 100 mL. Utiliser l'équation (1) pour déterminer la quantité d'ions hydroxyde n(HO -) consommée lors de la transformation. n(HO -) = ni (HO - ) -n' n(HO -) =1,0 10-2 - 4,2 10-3 = 5,8 10-3 mol En déduire la quantité d'aspirine présente dans le ballon. D'après les nombres stoechiométriques de l'équation (1) : n(aspirine) = ½ n(HO-) = 2,9 10-3 mol En déduire la masse m d'aspirine contenue dans le comprimé. masse (g) = masse molaire (g/mol) * quantité de matière (mol) m = M n ; m = 180*2,9 10-3 =0,522 g = 5,2 10-1 g. Calculer l'écart relatif : Dm/m = (m-macide) / macide. Dm/m =(522-500) / 500 = 22/500 = 44/1000 = 0,044 = 4,4 %. Le résultat confirme-t-il l'indication " 500 mg " de la notice ? à 4,4 % près le résultat confirme l'indication de la notice.
L'aspirine pH8 : Expériences : A. On dispose de deux béchers contenant respectivement 50 mL de solution d'acide chlorhydrique et 50 mL de solution de soude. Les deux solutions ont la même concentration molaire : 0,1 moL/L. On ajoute dans chacun d'eux un comprimé d'aspirine pH8 et on agite. Après quelques minutes, on
constate que le comprimé s'est dissous dans le
bécher contenant la solution de soude alors que le
comprimé ajouté dans la solution d'acide reste
intact.
On écrase ensuite le comprimé, détruisant ainsi son enrobage, le bleu de bromothymol vire alors au jaune (sa couleur en milieu acide). Interpréter l'expérience A et justifier l'indication de la notice " comprimé gastro-résistant ". Un enrobage protège l'aspirine en milieu acide. Le pH de l'estomac est acide ( pH=2). Dans l'estomac, l'enrobage du comprimé empèche l'aspirine de se dissoudre. Cet enrobage est détruit en milieu basique : l'aspirine se dissout ensuite dans ce milieu basique. On qualifie l'aspirine pH8 d'aspirine " retard ", pourquoi ? L'aspirine pH8 ne peut pas se dissoudre dans l'estomac, milieu acide ( dissolution retardée). Celle-ci passe ensuite dans l'intestin où le pH est égal à 8. L'enrobage disparaît alors et l'aspirine se dissout dans l'intestin. Interpréter l'expérience B pour expliquer pourquoi, d'après la notice, les comprimés doivent être avalés " tels quels " (c'est à dire sans les croquer). En écrasant le comprimé, ou en le croquant, on détruit l'enrobage protecteur. On obtient une solution contenant l'aspirine où la forme acide AH est majoritaire. Dans quel(s) but(s) cette formulation a-t-elle été créée ? L'aspirine pH8 ne se dissolvant pas dans l'estomac, mais dans l'intestin, on évite les brûlures d'estomac.
|
||||||
|
|
||||||
|
|
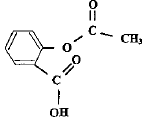 formule de l'acide acéthylsalycilique (aspirine).
formule de l'acide acéthylsalycilique (aspirine).