|
Electrodéposition et précipitation bac S Antilles 09/07 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||
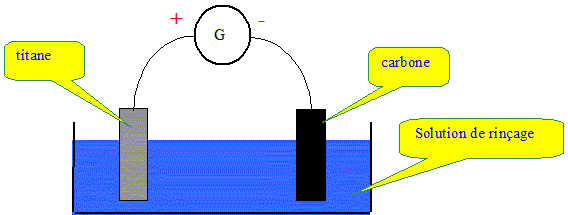
La cuve à électrodéposition contient une électrode en titane et une électrode en carbone. Ces deux électrodes sont immergées dans la solution de rinçage et sont alimentées par un générateur de courant continu comme le montre le schéma suivant :
Principe. L'électrodéposition du cuivre est un exemple d'électrolyse. Est-ce une transformation spontanée ? L'électrolyse n'est pas une transformation spontanée. C'est une transformation forcée qui nécessite un apport d'énergie sous forme électrique. Sur quelle électrode s'effectue le dépôt de cuivre mtallique ? Les ions cuivre présents en solution subissent une réduction à la cathode négative, le carbone dans ce cas. Ecrire la demi-équation électronique correspondante. Cu2+(aq) + 2e- = Cu(s). L'autre électrode est également le siège d'une transformation chimique. Est-ce une oxydation ou une réduction ? L'anode positive est le siège d'une oxydation.
L'équation d'oxydoréduction
globale qui se déroule dans la cellule
d'électrodéposition est la suivante
: 2Cu2+(aq) + 2H2O(l) =
O2(g) + 4H+(aq) +
2Cu(s). Ecrire la demi-équation électronique qui se déroule à l'anode de la cellule et identifier le couple oxydant / réducteur. 2H2O(l) = O2(g) + 4H+(aq) + 4e-. couple oxydant / réducteur :
O2(g) /
H2O(l)
La cellule est capable de ramener la teneur initiale en ion Cu2+ cm0=900,0 mg/L à une teneur résiduelle cmf = 30,0 mg/L pour une durée de fonctionnement égale à 6 heures, délai nécesaire entre deux rinçages successifs. Le volume de solution traitée pendant ce délai est V0=300 L.
Calculer la masse initiale m0 d'ions métalliques présents dans la solution au début du rinçage. m0 = Cm0 * V0 m0 = 900,0 * 300 =2,70 105 mg =270 g.
Calculer la masse finale mf d'ions métalliques présents dans la solution en fin de rinçage. mf = Cmf * V0 mf = 30,0 * 300 =9,00 103 mg =9,00 g. En déduire la masse mCu de cuivre déposée à la cathode. mCu = m0 -mf =270-9,00 = 261 g. Calculer les quantités de matière de cuivre présent sous ses deux formes nCu2+ et nCu en fin de rinçage. M(Cu) = 63,5 gmol Quantité de matière (mol) = masse (g) / masse molaire (g/mol) nCu2+ = mf /M(Cu) nCu2+ = 9,00/63,5 = 0,142 mol. nCu = mCu /M(Cu) nCu = 261/63,5 = 4,11 mol.
Compléter le tableau d'évolution ci-dessous avec les quantités de matière des espèces chimiques mises en jeu. Cu2+(aq) + 2e- = Cu(s) La quantité de matièred'électrons est égale à deux fois la qauntité de matière de cuivre
4,25-2xf =0,142 xf = 2,05 mol. ( 2,054)
Exprimer la qauntité d'électricité Q utilisée dans la cellule durant toute l'opération. 1F= 9,65 104 C Q = 9,65 104 n(e-). avec n(e-) = 4 xf = 4*2,054 = 8,216 mol. Q= 9,65 104*8,216 = 7,93 105 C. Exprimer puis calculer l'intensité I du courant, supposée constante. I = Q/Dt avec D t = 6*3600 = 2,16 104 s. I = 7,93 105 / 2,16 104 =36,7 A.
Dans l'installation industrielle, deux appareils montés en parallèle sur le circuit des eaux de rinçage assurent cette fonction d'élimination des ions Cu2+. Cela permet, par un dispositif annexe contenant un jeu d'électrodes supplémentaires, de récupérer le dépôt solide de cuivre tout en permettant à l'unité de traitement de fonctionner sans interruption. Une méthode plus classique consiste à précipiter les ions Cu2+(aq) présents dans les eaux de rinçage sous forme d'hydroxyde de cuivre (II), par ajout d'une solution d'hydroxyde de sodium (Na+(aq) + HO-(aq). La réaction est alors : Cu2+(aq) +2HO-(aq) = Cu(OH)2 (s). Calculer la masse de précipité d'hydroxyde de cuivre Cu(OH)2 produite lors de la précipitation de 4,11 mol d'ion Cu2+. Quantité de matière d'hydroxyde de cuivre = quantité de matière d'ion cuivre (II) = 4,11 mol Masse molaire de l'hydroxyde de cuivre (II) : 63,5+2*(16,0+1,0) = 97,5 g/mol. masse (g) = masse molaire (g/mol) * quantité de matière (mol) m = 97,5*4,11 = 401 g. Comparer cette masse avec la masse de cuivre obtenue. masse de cuivre obtenue : 261 g masse d'hydroxyde de cuivre (II) obtenue : 401 g soit environ 1,5 fois la masse de cuivre.
Ce résultat nous permet d'établir une comparaison des deux procédés ( électrodéposition et précipitation) sur la base des produits otenus dans chaque cas. Quel est le produit obtenu qu'il faudra extraire des eaux de rinçage, puis traiter chimiquement pour le recycler. hydroxyde de cuivre (II). Lequel des deux procédés donne un produit directement utilisale ? L'électrodéposition donne du cuivre pur, directement utilisable. |
||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||
|
|