|
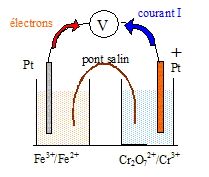
pile et oxydoréduction : Fe3+/Fe2+: et Cr2O72-/Cr3+ En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||
| .
. |
||
|
||
|
|
Données à 25 °C. Potentiels redox standard : Cr2O72-/Cr3+ : 1,33 V ; Fe3+/Fe2+: 0,77 V On considère une solution S à 1,0 × 10-1 mol.L-1 en sulfate de fer (II) et 2,0 × 10-2 mol.L-1 en chlorure de fer (III), suffisamment acidifiée pour qu’aucun précipité n’apparaisse.
demi-pile n°1 : Fe3++ e-=Fe2+ ; E1 = 0,77 + 0,06 log ([Fe3+] /[Fe2+]) =0,77 +0,06 log(0,02/0,1) = 0,73 V. demi-pile n°2 : Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O ; E2 = 1,33 + 0,06/6 log([Cr2O72-][H+]14/[Cr3+]2) [H+] = 0,1 mol/L ; E2 = 1,33 + 0,01 log (10-3 *10-14/ 10-2) = 1,18 V. E2 >E1, la demi pile n°2 constitue le pôle positif de la pile
fem de la pile : E= E2-E1 = 1,18-0,73 = 0,45 V. Equation de la réaction de la transformation qui se produit dans la pile lorsqu’elle débite : Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O 6 Fe2+ = 6 Fe3+ + 6 e- Cr2O72- + 14H+ +6 Fe2+ = 6 Fe3+ +2Cr3+ + 7H2O ; K = [Fe3+]6[Cr3+]2/([Cr2O72-][H+]14[Fe2+]6). E°2-E°1 = RT/nF ln K = ; 1,33-0,77 = 8,31*298 / (96500 *6) ln K ; 0,56 = 4,28 10-3 lnK ; ln K= 130,93 ; K= 7,3 1056. quotient de réaction initial Qr,i = [Fe3+]i6[Cr3+]i2/([Cr2O72-]i[H+]i14[Fe2+]i6) Qr,i =0,026*0,01/(10-3*10-14*10-6)=6,4 1010. Qr,i < K donc évolution dans le sens direct, de la gauche vers la droite. valeur du quotient de réaction lorsque la pile s’arrêtera de fonctionner : Qr = K
|
|
|
|