|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||
| .
. |
||||||||||||
|
||||||||||||
|
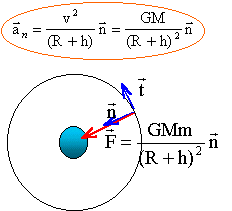
On note G la constante de gravitation, M la masse de la Terre, R le rayon de la Terre.. Un satellite terrestre, de masse m, décrit une orbite circulaire à une altitude z = 600 km.
corrigé le satellite est soumis à la seule force de gravitation centripète exercée par la planète
M : masse (kg) de la planète ; m : masse du satellite (kg) ; R (m) rayon planète ; h (m) altitude depuis le sol suivant l'axe n la seconde loi de Newton s'écrit : GMm /(R+h)² = m aN= mv²/ (R+h) d'où la valeur de la vitesse (m/s): v² =GM / (R+h). indépendante de la masse du satellite la force de gravitation étant perpendiculaire à la vitesse à chaque instant, ne travaille pas et en conséquence ne modifie pas l'énergie cinétique du satellite. la valeur de la vitesse reste donc constante : mouvement uniforme. Par contre la direction de la vitesse change et l'accélération n'est pas nulle. autre satellite terrestre de masse m' = 2m évoluant sur la même orbite : v² =GM / (R+h). indépendante de la masse du satellite, donc les deux satellites ont la même vitesse. satellite dont l'altitude est notée z". Sa vitesse est v" telle que v"=½v ; calcul de z" : v²= GM/(R+z) ; v"2 = GM/(R+z") = 0,25 v² = 0,25 GM/(R+z) 1/(R+z") = 0,25/(R+z) ; R+z = 0,25R+0,25 z" ; z" = 4(0,75 R+ z)= 4(0,75*6380+600)=2,15 104 km.
|
||||||||||||
|
On désire étudier l'influence de certains facteurs sur une réaction d'estérification. Pour cela on fait deux expériences de synthèse de l'éthanoate de 3-méthylbutyle de formule CH3-COO-CH2-CH2-CH(CH3)2. à partir de l'acide éthanoïque et du 3-méthylbutan-1-ol. Lorsque la transformation chimique est achevée, on dose la quantité d'acide éthanoïque restant par une solution d'hydroxyde de sodium Na+ + HO-, de concentration molaire cB= 2,0 mol/L. Soit VB le volume de solution d'hydroxyde de sodium ajouté à l'équivalence pour doser l'acide restant.
corrigé équation de cette réaction d'estérification : acide éthanoïque CH3-COOH ; (CH3)2CH-CH2-CH2OH : 3-méthylbutan-1-ol CH3-COOH + (CH3)2CH-CH2-CH2OH = CH3-COO-CH2-CH2-CH(CH3)2 + H2O lente, athermique, limitée par l'hydrolyse de l'ester. équation de la réaction de dosage de
l'acide éthanoïque restant par la solution d'hydroxyde de sodium : réactif limitant dans chacune des deux expériences d'estérification : expérience n°1 : proportions stoechiométriques expérience n°2 : acide en défaut, alcool en large excès. expression littérale de la quantité d'acide éthanoïque nacide restant : nacide = nac- nester = cBvB nacide 1= 2*17 10-3 = 3,4 10-2 mol ; nacide 2= 2*2,5 10-3 = 5 10-3 mol ; quantité d'ester formé nester : nester = nac- nacide = nac-cBvB nester 1 =0,1-3,4 10-2 =6,6 10-2 mol ; nester 2 =0,1-5 10-3 =9,5 10-2 mol rendement : nester / nac= Qté de matière d'ester / Qté de matière initiale de réactif limitant exp n°1 : 6,6 10-2 / 0,1 = 0,66 ( 66 %) ; exp n°2 : 9,5 10-2 / 0,1 = 0,95 ( 95 %) Le résultat était prévisible : en ajoutant l'un des réactifs en excès on déplace l'équilibre vers la droite, consommation du réactif en excès et formation de l'ester ( loi de Le Chatelier ) en remplaçant l'acide éthanoïque par l'anhydride acétique CH3-CO-O-CO-CH3, la transformation est totale et exothermique. CH3-CO-O-CO-CH3 + (CH3)2CH-CH2-CH2OH = CH3-COO-CH2-CH2-CH(CH3)2 +CH3-COOH
|
||||||||||||
|
A- parmi les constituants du lait, le lactose est l'un des principaux glucides. Ce dernier en présence de bactérie, se dégrade et se transforme en acide lactique de formule semi-développée CH3-CHOH-COOH.
B- Dans la suite du problème, le couple acide/base sera noté AH/A-. La teneur en acide lactique d'un lait est un critère de fraicheur. Si la teneur dépasse 5,0 g/L, le lait caille. Pour un lait frais cette teneur se situe autour de 1,7 g/L. On donne la masse molaire de l'acide lactique M= 90,0 g/mol.
C- Après quelques jours de conservation du lait, on veut
tester son acidité. Pour cela on procède en présence de
phénolphtaléine, à un titrage par une solution aqueuse d'hydroxyde de
sodium de concentration molaire cB=1,00 10-1
mol/L.
corrigé groupes caractéristiques présents dans l'acide lactique : -CHOH alcool secondaire ; -COOH : acide carboxylique couple acide /base : acide lactique / ion lactate ; CH3-CHOH-COOH / CH3-CHOH-COO-. équation chimique de la réaction de l'acide lactique aqueux et l'eau : AH+H2O= A-+H3O+. rapport [A-]éq / [AH]éq dans le lait étudié : pH= pKa + log ([A-]éq / [AH]éq ) log ([A-]éq / [AH]éq ) = pH-pKa = 6,7-3,9 = 2,8 ; [A-]éq / [AH]éq = 102,8 = 631 à pH > pKa, la forme A- prédomine. A l'équivalence les quantités de matière mises en présence sont en proportions stoechiométriques ; avant l'équivalence l'acide est en excès dans le becher; après l'équivalence la soude est en excès. équation chimique de la réaction de titrage : AH+HO- = A- + H2O nouvelle concentration molaire c'A = CbVb/V0 =0,1*13,3/20 = 6,65 10-2 mol/L titre massique ( g/L) = c'a*M( acide lactique) = 6,65 10-2 *90=5,98 g/L. Le lait est caillé.
|
||||||||||||
|
|