|
d'après
concours controleur de la concurence
et de la répression des fraudes 2000 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
||
| .
. |
||
|
||
|
|
Un contrôleur de la concurrence, de la consommation et de la répression des fraudes a pour mission d’enquêter sur la qualité et la sécurité des produits fabriqués par une société. I - Le contrôleur se présente au responsable de l’entreprise et, après lui avoir expliqué l’objet de sa visite, il demande à visiter les chaînes de fabrication. Il y est accompagné par Monsieur DURAND, responsable qualité de l’usine. Dans un des ateliers de fabrication, l’attention du contrôleur est attirée par une caisse en bois parquée dans un coin, pleine de composants électriques, tous identiques. Intrigué par cet endroit peu habituel pour stocker des produits, le contrôleur interroge Monsieur DURAND qui avoue ignorer pourquoi cette caisse se trouve en pareil endroit. Ce dernier ne connaît pas davantage la nature exacte de ces composants. Il sait simplement, compte tenu de l’activité de cette partie de l’usine, en outre vouée à un seul type de composants, qu’il s’agit soit de résistances, soit de condensateurs, soit de bobines d’auto-induction. Il prie Monsieur DURAND de lui amener un oscilloscope, une résistance, un condensateur, un générateur de tension continue et un générateur de tension sinusoïdale, ainsi qu’un interrupteur, ce que Monsieur DURAND accepte bien volontiers.
corrigé 1. le composant est une bobine inductive caractérisée par son inductance L et sa résistance r. Alimentée par un générateur de tension continue, en régime permanent, la bobine se comporte comme un résistor de résistance r. Le montage est alors équivalent à deux résistances en série. La tension aux bornes de l'ensemble est 6 V ; la tension aux borne de R vaut 5V; la tension aux borne de r vaut 1 V ; donc r=R/5 = 40 W. 2. En associant un générateur basse fréquence (GBF) en série avec un condensateur et une bobine, on observe aux bornes du condensateur des oscillations sinusoïdale amorties. Ce qui confirme l'hypithèse formulée en 1. 3. Dipole RLC oscillations forcées : à la résonance d'intensité, l'impédance est minimale égale à r = 240 W ; d'où l'intensité efficace I= 2,5 / 40 = 0,0625 A = 62,5 mA ( accord avec 1.) fréquence propre = féquence du générateur à la résonance d'intensité d'où la pulsation w0 = 2pf0=6,28*1070 =6720 rad/s A la résonance LCw20 =1 d'où L= 1/(Cw20 )= 1/(2,2 10-6*67202)
= 0,01 H
soit 4,887*1,6 10-19 = 7,82 10-19 J longueur d'onde du photon émis : E=hc/l soit l = hc/E = 6,62.10-34 *3 108 / 7,82 10-19 =2,54 10-7 m = 254 nm ( domaine UV) cultures sous serres : traitement de l'eau et des surfaces ; réduction des maladies postrécoltes dans les instituts de beauté : bronzage
|
|
|
I. On réalise un mélange contenant 10 mL d’une solution d’acide éthanoïque à 0,1 mol.L -1 de pKa = 4,8 et 4 mL de solution de soude de même concentration. Calculer le pH de cette solution. En déduire les concentrations de toutes les espèces en équilibre. II. L’oxygène et le soufre ont respectivement pour numéro atomique Z = 8 et Z = 16.
corrigé Dosage acide base avec arrêt avant l'équivalence : CH3COOH + HO- = CH3COO-+H2O n( acide) initial =10*0,1 = 1 mmol ; n( base) initial =4*0,1 = 0,4 mmol ; composition du mélange final : n( CH3COOH )fin =1-0,4 = 0,6 mmol ; n( CH3COO- )fin =0,4 mmol ; n( HO- )fin =0 mmol ; n( Na+ )fin =0,4 mmol ; pH= pKa + log ([CH3COO-]/[CH3COOH]) = 4,8 + log (0,4/0,6)= 4,62 doù [H3O+]= 10-4,62 = 2,38 10-5 mol/L ; [HO-] = 10-14 /2,38 10-5 =4,2 10-10 mol/L volume du mélange : 10+4 = 14 mL. [CH3COOH] = 0,6/14 = 4,28 10-2
mol/L ; [CH3COO-] =0,4/14
= 2,86 10-2 mol/L ;[Na+]=2,86
10-2 mol/L
xygène : K2L6 ; S : K2L8M6 : même structure électronique externe.
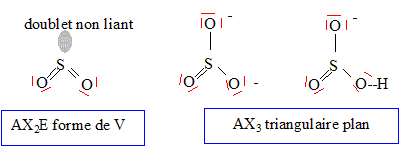
L’hydrogénosulfite est à la fois un acide et une base. en tant qu'acide : HSO3- =SO32- + H+ ; Kr1 = [SO32-][H+] /[HSO3-] en tant que base : HSO3- + H+ = H2SO3 ; Kr2 =[H2SO3]/([H+ ][HSO3-]) H2SO3 = HSO3- + H+ ; Ka1 = [H+ ][HSO3-]/[H2SO3] = 1/Kr2 ; Kr2 = 1/ Ka1 = 101,91 . HSO3- =SO32- + H+ ; Ka2 = [SO32-][H+] /[HSO3-] = Kr1 = 10 -7,22.
|
||
|
Les esters sont des composés organiques très répandus dans la nature ; ils contribuent au parfum de nombreux végétaux. Un gramme d’un ester A monofonctionnel Cx Hy Oz est saponifié par 8,6 ml de soude à 1 mol.L -1 . Par hydrolyse de A on obtient un composé B et du méthanol.
Données : Masse atomique (en g.mol -1) C = 12 ; H = 1 ; O = 16 . corrigé hydrolyse d'un ester : réaction limitée par l'estérification, réaction inverse de l'hydrolyse R-COO-R' + H2O = R-COOH + R'-OH saponification d'un ester : réaction lente mais totale : R-COO-R' + Na+ + HO- --> R-COO-+ Na+ + R'-OH Quantité de matière de soude = quantité de matière d'ester = 8,6 10-3 mol Quantité de matière (mol)=masse (g) / masse molaire (g/mol) d'où M= m/n = 1/8,6 10-3 = 116 g/mol formule brute d'un ester : Cn H2n O2 ; M=12 n+2n+32 = 14 n+32 = 116 soit n = 6 ; C6H12O2 ou bien C4H9-COO-CH3 attendu que la saponification donne du méthanol CH3-CH2-CH2-CH2-COO-CH3 pentanoate de méthyle (CH3)2CH-CH2-COO-CH3 3-méthylbutanoate de méthyle (CH3)3C-COO-CH3 2,2-diméthylpropanoate de méthyle CH3-CH2-*CH(CH3)-COO-CH3 2-méthylbutanoate de méthyle et B : CH3-CH2-*CH(CH3)-COOH * carbone asymétrique
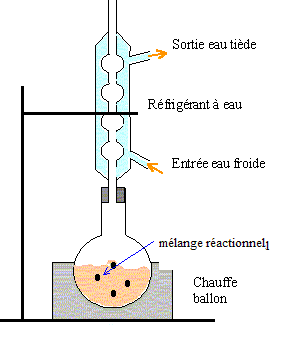
Chauffage à reflux : le chauffage à reflux permet d'accroître la vitesse de la réaction chimique tout en évitant les pertes de matière : les vapeurs sont condensées dans le réfrigérant droit qui surmonte le ballon, et retombent dans le ballon.
|
||
|
|
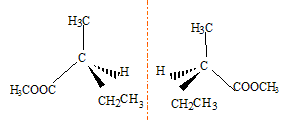 énantiomères
énantiomères