|
acide
acétique, spectrophotométrie, ultrasons,
optique , électronique ( AO)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
corrigé formule brute : C2H4O2 ; autre nom : acide éthanoïque ; formule semi développée : 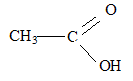
On veut fabriquer 2,0 L d'une solution aqueuse à 1,0 mol/L de cet acide : masse de 1 L de solution commerciale : 1,05 kg = 1050 g n= m/M = 1050/60,05 = 17,5 mol dans 1 L facteur de dilution F= 17,5 / 1 = 17,5 volume de solution mère à prélever pour préparer 2 L de solution à 1 mol/L : 2 /17,5 = 114,4 mL liste du matériel : fiole jaugée 2 L ; burette graduée ou pipette graduée + pipeteur consignes de sécurité : port de blouse, gants lunettes et travail sous hotte. prélever 114,4 mL de la solution commerciale ( burette graduée ou pipette graduée) ; verser dans la fiole jaugée de 2 L, contenant un peu d'eau distillée. compléter avec eau distillée jusqu'au trait de jauge ; agiter pour rendre homogène préparer 500,0 mL d'une solution d'acide acétique de concentration 0,0100 mol/L à partir de la solution précédente : F= 1/0,01 = 100 ; volume pipette jaugée = 500/100 = 5 mL prélever 5 mL de la solution mère ( pipette jaugée + pipeteur) ; verser dans la fiole jaugée de 500 mL. compléter avec eau distillée jusqu'au trait
de jauge ; agiter pour rendre
homogène.
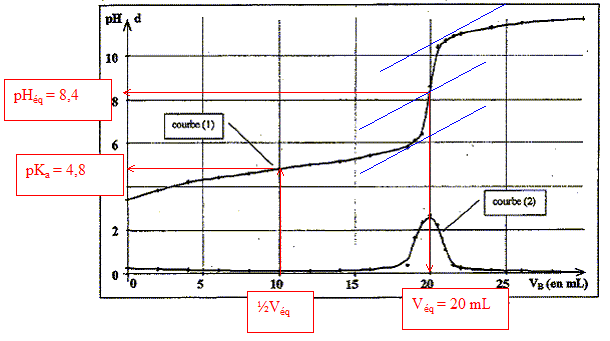
étalonnage du pHmètre : placer la sonde de mesure dans une solution tampon pH=7 : ajuster la lecture placer la sonde ( après rincage dans une solution tampon à pH=9 : régler la pente en ajustant le pH courbe 1 : pH=f(Vb) : courbe 2 : courbe dérivée définition de l'équivalence : à l'équivalence les quantités de matière d'acide et de base mis en présence sont en proportions stoechiomètriques. Avant l'équivalence, dans le bécher, l'acide est en excès ; après l'équivalence la base est en excès.
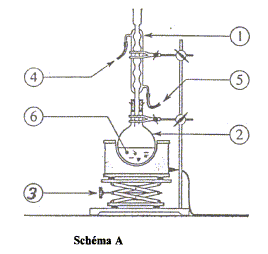
l'acide acétique est un acide faible : le pH à l'équivalence est différent de 7 ; le pH à la demi-équivalence permet de déterminer le pKa ( on trouve 4,8 alors que le pKa d'un acide fort est égal à zéro) montage à reflux : permet d'accélérer une réaction chimique lente en évitant les pertes de matière des réactifs et produits ( les vapeurs se condensent et retombent dans le milieu réactionnel.
1 : réfrigérant ; 2 : ballon ( contenant les réactifs et les produits) ; 3 : élévateur à croisillons ; 4 : sortie de l'eau ; 5 : entrée de l'eau : 6 : pierre ponce nom et les caractéristiques de cette réaction : estérification, lente athermique, limitée par l'hydrolyse de l'ester. on chauffe pour accélérer la réaction chimique. nom du composé organique obtenu (ester) : éthanoate de pentyle. équation chimique de la réaction si on remplace le pentan-1-ol par le propan-1-ol : CH3-CO2H + CH3-(CH2)2-OH= CH3-CO2-(CH2)2-CH3 + H2O.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
corrigé masse de peroxodisulfate d'ammonium (NH4)2S2O8 à peser pour préparer 100 mL de solution de S à 0,01 mol/L : M((NH4)2S2O8 ) = 2*(14+4) + 2*32+8*16 = 228 g/mol Quantité de matière (mol) : volume solution (L) * concentration (mol/L) = 0,1*0,01 = 10-3 mol masse(g) = quantité de matière (mol) * masse molaire (g/mol) = 10-3*228 = 0,228 g. couples oxydant/réducteur : S2O82- /SO42- ; I2 /I- . grandeur physique mesurable à l'aide d'un spectrophotomètre : absorbance, notée A, grandeur sans unité [I2] et l'absorbance A sont proportionnelles, du moins aux faibles concentrations. A= k [I2] k constante dépendant de la largeur de la cuve et de la longueur d'onde de la lumière utilisée. vitesse molaire volumique de formation du diode à la date t= 20 min : coefficient directeur de la tangente à la courbe à la date considérée.
vitesse de disparition des ions peroxodisulfate à la même date : n(S2O82- = = n( I2) d'après les coefficients de l'équation : en conséquence la vitesse de disparition des ions peroxodisulfate à t = 20 min est égale à la vitesse molaire volumique de formation du diode à la date t= 20 min.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Un générateur (GBF) de tension sinusoïdale alimente un émetteur E d'ondes ultrasonores. On visualise cette tension sur la voie A d'un oscilloscope. Après propagation dans l'air le signal est détecté par un récepteur R à ultrasons relié à la voie B de l'ozcilloscope. On peut déplacer R sur un rail rectiligne qui permet de mesurer la distance émetteur-récepteur ER. La position fixe de E correspond à la mesure 0.
corrigé 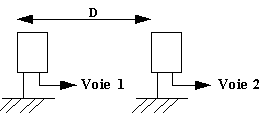
les symboles : kHz = 103 hertz ; et MHz = 106 hertz les fréquences correspondant à des sons audibles sont comprises entre 2 Hz et 20 kHz : 300 Hz ; 3000 Hz ; 3 Hz correspond à un infrason
l'amplitude : 3 div soit 1,5 V ; la période : 5 div soit 5*5 10-6 = 2,5 10-5s et la fréquence : f=1/T=1/2,5 10-5= 40 000 Hz = 40 kHz. On éloigne R de E : la période ne change pas ; l'amplitude du signal observé sur la voie B diminue. longueur d'onde : l = 8,5 10-3 m ; célérité de l'onde ultrasonore v = l f = 8,5 10-3*40000 =340 m/s.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
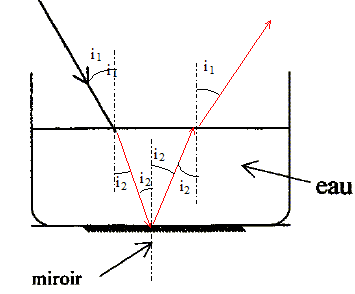
corrigé He : hélium ; Ne : néon. monochromatique : une seule fréquence, une seule couleur. intervalle des longueurs d'onde des radiations visibles par l'oeil humain : 400 nm ; 800 nm. l= 632,8 nm : couleur jaune orange principale précaution à prendre lors de l'utilisation d'un laser : ne pas diriger le faisceau vers les yeux vitesse de propagation de cette lumière dans l'air : 3 108 m/s. angle de réfraction du rayon pénétrant dans l'eau : n1 sin i1 = n2 sin i2 ; sin i2 = n1 sin i1/ n2 =sin 30 / 1,33 =0,376 ; i1 = 22°. visualiser le faisceau dans l'air : envoyer de la fumée sur le trajet du faisceau. visualiser le faisceau dans l'eau : placer des particule en suspension ( KMnO4), utiliser du lait ou de la fluoresceine.
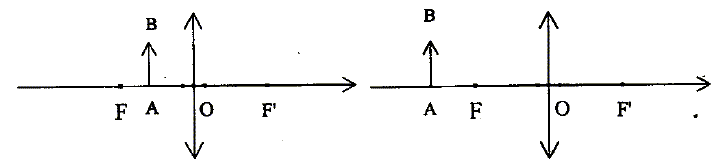
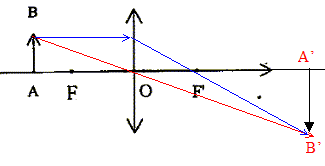
Le schéma b est correct ; dans le schéma a, la lentille fonctionne en loupe : on ne peut pas obtenir une image sur un écran.
il faut mesurer OA et OA' pour calculer la distance focale. On distingue rapidement une lentille convergente d'une lentille divergente de la manière suivante : une lentille convergente a les bords minces, une lentille divergente a les bords épais. La vergence C de l'ensemble est égale à la
somme des vergences de chaque lentille et C doit être
positive ( l'ensemble des deux lentilles accolées
doit être convergent) donc 21 d
ou 27 d
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
corrigé pour étudier les variations de la tension uS au cours du temps on utilise un oscilloscope. Relier la masse du GBF à celle de l'oscilloscope, la voie 1 à la sortie du GBF et la voie 2 au point S. relation entre l'amplitude uE de la tension d'entrée et la tension crète à crète UCC délivrée par le GBF : UE = ½UCC.
A : coefficient d'amplification en tension A= (R1+R2) / R1. amplitude de l'intensité du courant traversant Re : US= 3,5*UE = 7 V ; US=ReI soit I= US/Re=7/100 = 0,07 A. intérêt de ce montage : amplificateur de tension ( A= 21) .
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|