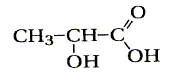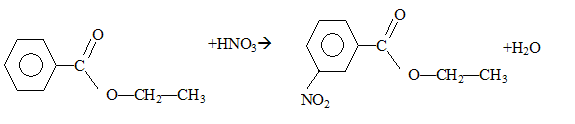|
d'après bts biochimie 2005 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
|
|
L'acide lactiquede formule brute C3H6O
est un composé organique de formule semi-développée L'acide lactique se forme en très petite quantité dans les muscles au cours d'efforts physiques. La libération de grande quantité d'acide lactique peut provoquer des crampes.
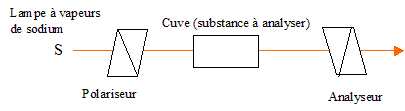
corrigé substance optiquement active : solide, liquide ou substance dissoute en solution provoquant une rotation du plan de polarisation de la lumière polarisée traversant la substance. La polarimétrie, technique de chimie analytique permet de doser la teneur d'une solution en substances optiquement actives.
L'axe de l'analyseur est perpendiculaire au polariseur. L'intensité de la lumière transmise par le dispositif est nulle. En remplissant la cuve d'eau, composé optiquement inactif, l'intensité de la lumière transmise est nulle. En remplissant la cuve d'une solution aqueuse de saccharose, composé optiquement actif, l'intensité de la lumière transmise n'est pas nulle : on retrouve une intensité nulle, en tournant l'analyseur d'un angle a. Loi de Biot traduit la proportionnalité entre le pouvoir rotatoire d'un milieuet les concentrations en produits optiquement actifs (dextrogyres ou lévogyres) : a = [a]l, T.C.l a (°) angle de rotation du plan de vibration des ondes lumineuses ; [a] : pouvoir rotatoire spécifique ( ° m2 kg-1 ); C: concentration ( kg m-3 ) ; l : longueur (m) de cuve
a = [a]l, T.C.l donne C= a /( [a]l, T.l)=5,17 /(0,190*0,3)= 90,7 kg m-3= 90,7 g/L Masse molaire acide lactique C3H6O : M= 12*3 + 6+16 = 58 g/mol C= 90,7 / 58 = 1,56 mol/L. solution d'acide d'acide L-lactique et d'une solution d'acide D-lactique aux mêmes concentrations : mélange racémique. angle de déviation du plan de polarisation de la lumière : a = [aL]l, T.C.l + [aD]l, T.C.l = ( [aL]l, T+ [aD]l, T) C l Les pouvoirs rotatoires spécifiques de deux énantiomères sont égaux en valeur absolue mais de signes opposés : [aL]l, T+ [aD]l, T=0 d'où a=0
|
||||||||||||||||||||||||||||||||||||
corrigé a : noyau d'hélium ; b-: électrons ; b+ : positons. 4019K = 4018Ar + AZX conservation du nombre de nucléons : 40 = 40 +A d'où A=0 conservation de la charge : 19=18+Z d'où Z= 1 ; on identifie X à un positon. La demi-vie est la durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés. lt½=ln2 soit l = ln2 / t½ = ln2 / 1,3 109 = 5,33 10-10 an-1. nombre d'atomes de potassium 40 ( NK) et le nombre d'atomes d'argon 40 ( NAr) à la date t.: NK= mK /M(K) * NA=1,57 10-3 / 40 *6,02 1023 = 2,36 1019 atomes NAr= mAr /M(Ar) * NA=82 10-6 / 40 *6,02 1023 = 1,23 1018 atomes à t=0 : N0= NK(t=0) Chaque fois qu'un noyau de potassium 40 se désintègre il se forme un noyau d'argon 40 : à la date t, N0-NK atomes de potassium 40 ont disparu ; il s'est formé NAr =N0-NK atomes d'argon 40. D'où : N0 =NAr +NK. loi de décroissance radioactive : NK(t) = N0 e(-lt) soit ln(NK(t) / N0 ) = l t. t = -1/l ln(NK(t) / N0 ) =-1/5,33 10-10 ln(2,36 1019 / 2,48 1019) = 9,47 107 ans.
|
|||||||||||||||||||||||||||||||||||||
|
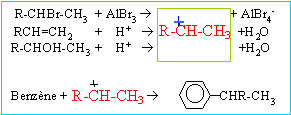
Synthèse du benzoate d'éthyle à partir du benzène : 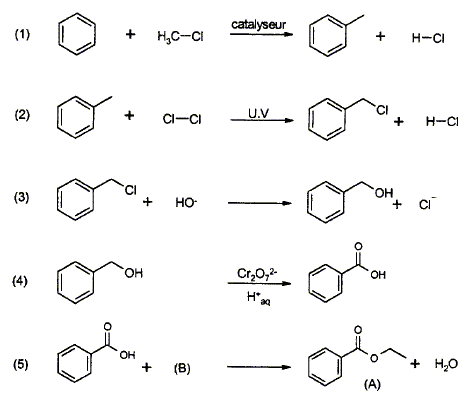
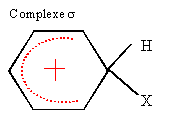
corrigé étape 1 : substitution électrophile ( Friedel et Craft) sur le noyau benzénique ; le catalyseur utilisé est un acide de Lewis AlCl3, AlBr3.
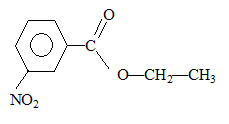
étape 3 : substitution nucléophile ( SN1 ou SN2) de l'atome de chlore par le groupe -OH. étape 4 : 2 fois{Cr2O72- +14 H++6e- = 2Cr3+ +7H2O} réduction de l'oxydant. 3 fois{ Ph-CH2OH + H2O = Ph-COOH +4 H++4e- } oxydation du réducteur 2 Cr2O72- +3Ph-CH2OH + 16H+ =4Cr3+ + 3 Ph-COOH +11H2O étape 5 : estérification; B est l'éthanol CH3-CH2-OH. mononitration par action de l'acide nitrique : substitution électrophile ( nitration) sur le noyau benzénique. le groupement -COO-CH2-CH3 , attracteur d'électrons, désactive ( diminue la densité électronique ) le noyau benzénique. Le sommet situé en "méta" est le moins désactivé. composé majoritairement formé :
|
|||||||||||||||||||||||||||||||||||||
|
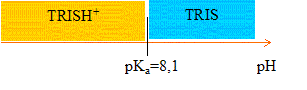
Le trihydroxyméthyl aminométhane ((HO-CH2)3CNH2), appelé TRIS, est souvent utilisé comme tampon. Sa zone de tampon s'étend de 7,0 à 9,0. La constante d'acicité du couple mis en jeu (HO-CH2)3CNH3+/ (HO-CH2)3CNH2 est Ka= 8,7 10-9. (HO-CH2)3CNH2 + H2O = (HO-CH2)3CNH3+ + HO-. (TRIS) + H2O = (TRISH+) + HO-.
corrigé TRISH+ + H2O =TRIS + H3O+ ; Ka = [TRIS][ H3O+]/[TRISH+ ] (1) TRIS + H3O+ = TRISH+ + H2O ; constante d'équilibre 1/Ka H3O+ + HO- = 2H2O ; Ke = 10-14 à 25°C (2) 2H2O = H3O+ + HO- , constante d'équilibre Ke (1) +(2) donne : TRIS +H2O =TRISH+ + HO- constante d'équilibre Ke / Ka= 10-14 / 8,7 10-9 = 1,15 10-6. Le pouvoir tampon est maximal à pH=pKa = -log 8,7 10-9 = 8,0,6 voisin 8,1.
pH= pKa + log ([TRIS]/[TRISH+]) avec : [TRIS] = C1V1/(V1+V2) ; [TRISH+] = C2V2/(V1+V2) ; [TRIS]/[TRISH+] = C1V1/(C2V2) = 200/(1,2*200) = 1/1,2 =0,833 ; log 0,833 = -0,079 pH= 8,06-0,079 = 7,98. ajout d'acide chlorhydrique : TRIS + H3O+ = TRISH+ + H2O ; K= 1/Ka = 1,15 108 donc réaction totale Quantité de matière (mol) : d'acide chlorhydrique ajouté : c0v0 = 6*5 10-4 = 3 10-3 mol Dans 100mL de tampon : n(TRIS) initiale : C1V1 *100/300 = 0,0667 mol ; n(TRISH+) initiale : C2V2*100/300 = 0,080 mol ; 3 10-3 mol de TRIS disparaît : ( il reste 0,0637 mol TRIS) et 3 10-3 mol de TRISH+ apparaît ( il y a finalement : 0,083 mol TRISH+) [TRIS]/[TRISH+] = 0,0637/0,083 = 0,768 ; log 0,768 = -0,115 pH= 7,98-0,115 = 7,86 variation relative de pH : 100*0,115/7,9 = 1,3 % Le pH varie très peu lors de l'ajout modéré d'acide chlorhydrique : c'est une des propriétés d'une solution tampon.
|
|||||||||||||||||||||||||||||||||||||
|
|