|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Léthanoate de pentyle ou parfum de poire est plus connu sous le nom d'acétate d'amyle. Sa formule semi-développée est : 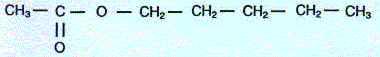 Etude théorique :
Etude cinétique :
étude théorique :
Dans cette molécule la fonction ester est présente. Cet ester est obtenu à partir d'un acide carboxylique, l'acide éthanoïque CH3-COOH ( noté A) et d'un alcool primaire, le pentan-1-ol ( noté B) CH3-CH2-CH2-CH2-CH2OH Equation de la réaction conduisant à l'ester : CH3-COOH + CH3-CH2-CH2-CH2-CH2OH = CH3-COO-CH2-CH2-CH2-CH2-CH3 + H2O ( eau) cette réaction porte le nom d'estérification. Etude cinétique : Mode opératoire permettant de suivre l'évolution de la quantité de matière du réactif A : A l'instant initial, mélanger les réactifs, fractionner le milieu réactionnel en 10 parties identiques, placées dans un bain thermostaté. à intervalle de temps régulier, prélever l'une des parties ; plonger l'erlenmeyer dans un bain d'eau glacée ( blocage cinétique) puis effectuer un dosage de l'acide restant par une solution titrante d'hydroxyde de sodium. rôle de l'acide sulfurique : catalyseur ; ce catalyseur accélère la réaction ; il est régénéré à la fin de celle-ci et en conséquence n'intervient pas dans l'équation de la réaction. tableau d'évolution :
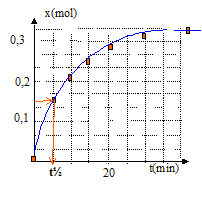
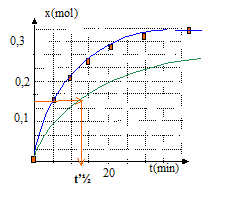
vitesse volumique v = 1/V dx/dt avec V = volume constant du milieu réactionel ( V=83 mL) La vitesse diminue au cours du temps car les concentrations (facteur cinétique) des réactifs diminuent. A partir de t= 50 min, l'avancement est constant : en conséquence la composition du milieu réactionnel n'évolue plus ; on atteind un état d'équilibre chimique. temps de demi-réaction t½ : durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final t½ voisin de 6 min Si la synthèse se fait sans ajout d'acide sulfurique, la vitesse de la réaction est plus faible : l'état déquilibre sera plus long à atteindre, mais la composition de cet état ne changera pas ; dans ce cas le temps de demi réaction t'½ sera supérieur à la valeur précédente.( courbe verte ci-dessous)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|