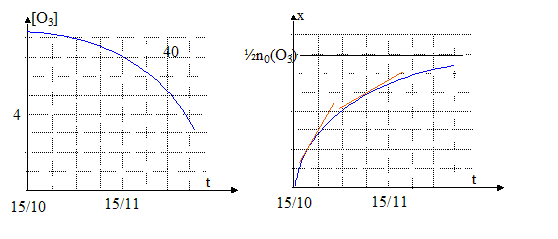|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts.
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
|
L’histoire des CFC (chloro-fluoro-carbones, nommés egalement fréons) est très curieuse : une molécule très stable, non toxique, ininflammable, très utilisée pour la réfrigération, dans les sprays et comme isolants. Décrite à l’origine comme un progrès technique remarquable, elle fut ensuite suspectée d’être dangereuse pour l’atmosphère. Elle est maintenant vue comme une menace pour la vie terrestre. Certains refusent d’accepter la responsabilté des CFC dans la déplétion de la couche d’ozone et accusent les grands groupes chimiques de vouloir banir les CFC pour les remplacer par de nouveaux produits plus chers. L’histoire de l’ozone illustre comme il est difficile de prédir précisément la réponse de notre planète aux modifications humaines mais aussi comme les discussions entre scientifiques peuvent être si émotionnelles. D'après Is The Temperature Rising? S. George Philander (Ed. Princeton Paperbacks) I. Création de l’ozone dans la stratosphère ; cycle de Chapman (prix Nobel 1985)
II. Destruction de l’ozone stratosphérique par les CFC Dans les années 1970, Molina et Rowland, qui partagèrent le prix Nobel avec Chapman, prédirent que la principale qualité des CFC, à savoir leur stabilité, pouvait se révéler dangereuse pour la couche d’ozone. Comme les CFC ne réagissent pas avec d’autres réactifs, ils peuvent rester dans l’atmosphère très longtemps et être dispersés vers les hautes altitudes où la lumière peut les décomposer enélements plus simples. Rowland et Molina émirent l’hypothèse que l’un d’eux, le chlore, pouvait jouer le rôle de catalyseur dans la décompositon de l’ozone, suivant le cycle : Cl + O3 --> ClO + O2 et ClO + O --> Cl + O2
III. Le trou d’ozone au dessus de l’Antarctique Lors de la longue nuit polaire, les températures au-dessus du pôle Sud atteignent les - 80°C. Le pôle est alors recouvert de nuages de cristaux de glace.
IV. L’ozone ; un polluant dans les grandes villes Au niveau du sol, l’ozone est beaucoup moins recherché qu’en haute altitude : il est très agressif envers les poumons et constitue l’un des polluants les plus sérieux.
V. Mesure du taux d’ozone ; suivi de la réaction simplifiée 2 O3 = 3 O2 Embarqué dans un
satellite, un spectrophotomètre peut mesurer la quantité d’ozone au
pôle Sud. On s’est placé à l
= 240 nm.
Une réaction à trois molécules est plus rare qu’une réaction classique entre deux réactifs : Une réaction chimique ayant lieu entre A et B, donnant C+D signifie : des liaisons chimiques sont rompues, dautres sont créées pour passer du système (A + B) au système final (C + D). Les chocs efficaces (chocs suffisamment énergétiques pour rompre les liaisons ) conduisent à ces ruptures,( il existe aussi des chocs élastiques qui ne cassent pas les liaisons) La probabilité de rencontres entre les particules et de chocs efficaces sera d'autant plus grande que la concentration ( ou la pression pour les gaz) sera plus grande La probabilité que trois particules se rencontrent est plus faible que pour deux particules. O2 + O + M =O3 + M* réaction (2) A basse altitude il y a beaucoup plus de dioxygène qu'à haute altitude : la réaction sera favorisée par la plus forte pression en O2 ( facteur cinétique : concentration ou pression d'un réactif) A haute
altitude il y a beaucoup plus d'atomes oxygène ( formé sous
l'action des UV) qu'à basse altitude : la réaction sera favorisée par
la plus grande quantité d'oxygène atomique, très réactif.
et ClO + O --> Cl + O2 (3) ajouter membre à membre : O3 + O-->2 O2. Une seule
molécule de chlore peut détruire des milliers de molécules d’ozone :
elle est consommée dans la réaction (1) mais régénérée dans la réaction (3). En fin de ce premier cycle elle demeure
disponible pour entamer un second cycle et ainsi de suite.
exemples : décomposition de H2O2 en présence de dioxyde de manganèse ; fabrication de NH3 en présence de fer ; diminution des émissions polluantes des pots d'échappement à l'aide d'un mélange de catalyseurs solides Pd, Pt , Rh. En plus des
cristaux de glace, il faut aussi des UV pour décomposer l’ozone : en juillet-août au pôle Sud
c'est l'hiver et la température est trop basse pour que l'ozone se
forme en grande quantité : facteur cinétique limitant ; par contre
l'ozone est en partie détruite par les UV ). En décembre, c'est l'été
austral. Les mois les plus favorables à l’observation d’un trou de
couche d’ozone sur
le pôle Sud sont juillet aout, hiver austral.
Le maximum
d’absorbance des molécules est très probablement dans le domaine des UV
car l'ozone stratosphérique, en filtrant une partie du rayonnement UV
solaire protège la vie sur terre.
Lorsqu'une lumière monochromatique d'intensité I0 traverse un milieu homogène, l'intensité de la lumière émergente I décroît exponentiellement lorsque l'épaisseur l du milieu absorbant augmente. I = I0 . e (- kl) k est une constante appelée coefficient d'absorption, caractéristique du milieu et de la longueur d'onde considérés. Dans le cas des solutions, la loi de Beer fait intervenir les concentrations. I = I0 . e (- elc) où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L). La relation fondamentale utilisée en spectrophotométrie est présentée sous la forme : A= log (I0/I) = elc ( A est l'absorbance ou densité optique)
[O3] =quantité de matière (mol) / volume (L)= (n0(O3)-2x) / V soit x =½( n0(O3) -V[O3] ) or la vitesse volumique v de réaction est égale à 1/V dx(t) / dt ; dx/dt = - ½Vd[O3]/dt ; v = -½d[O3]/dt graphes [O3] = f(t) et x = f(t) : De plus A= k [O3] = 0,1 [O3] soit [O3] = 10 A et x= ½( n0(O3) -V[O3] ) soit x= ½( n0(O3) -10AV ) d'où v =-5 dA/dt.
graphe x=f(t) : la vitesse de la réaction est proportionnelle au coefficient directeur de la tangente à la courbe à la date considérée. Ces coefficients directeurs diminuent au cours du temps ( les tangentes se rapprochent de l'horizontale) : la vitese de la réaction diminue donc au cours du temps.
|
|||||||||||||||||||||||||||||
|
|