|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
|
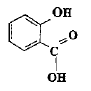
aspirine :
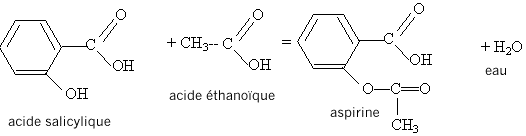
L'aspirine peut être obtenue par action de l'acide acétique ou éthanoïque sur le groupe hydroxyle -OH de l'acide salicylique; il s'agit d'une réaction d'estérification, lente, athermique, limitée par l'hydrolyse de l'ester. Equation de la réaction modélisant cette transformation :
Étude théorique de la réaction entre l'acide acétique et l'acide salicylique : On considère la transformation effectuée à partir d'un mélange initial de 0,10 mol d'acide acétique et 0,10 mol d'acide salicylique. Tableau descriptif de l'évolution du système chimique :
Qr =[CH3CO2R][H2O] /([CH3CO2H][ROH]) =[x/(0,1-x)]2 Calcul de la valeur Qr,i dans l'état initial : Qr,i=[CH3CO2R]i [H2O]i /([CH3CO2H]i [ROH]i) or [CH3CO2R]i =[H2O]i =0 donc Qr,i=0. La constante d'équilibre K vaut 7,0 10-3 : Qr,i< K Le critère d'évolution spontanée indique une évolution du système dans le sens direct, de la gauche vers la droite.
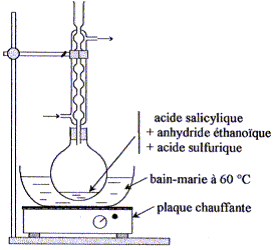
K= Qr éq =[CH3CO2R]éq [H2O]éq/([CH3CO2H]éq [ROH]éq) = (xf/(0,1-xf)2 Calcul de xf : (7 10-3)½ = = xf/(0,1-xf) 8,37 10-2 (0,1-xf) = xf soit xf = 7,7 10-3 mol. Taux d'avancement final t la transformation :t = xf/xmax avec xmax = 0,1 mol. t =7,7 10-3 / 0,1 = 7,7 10-2 (7,7 %). Une autre méthode de préparation : Le taux d'avancement étant très faible, on préfère préparer l'aspirine en faisant réagir l'acide salicylique sur de l'anhydride éthanoïque. Dans un ballon bien sec, on introduit avec précaution : - 10,0 g d'acide salicylique ;- 12,0 mL d'anhydride éthanoïque mesurés à l'éprouvette graduée ; - quelques gouttes d'acide sulfurique concentré. On réalise le montage représenté ci-dessous puis on chauffe le mélange réactionnel au bain-marie à 60 °C pendant une vingtaine de minutes.
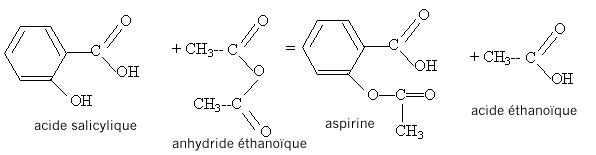
Type de montage : chauffage à reflux Rôle du réfrigérant à boules : condensation des vapeurs ; les espèces condensées retombent dans le milieu réactionnel ; on évite ainsi les pertes de matière. On chauffe le mélange réactionnel afin d'augmenter la vitesse de la réaction ; la température est un facteur cinétique. Rôle de l'acide sulfurique : catalyseur Il utiliser un ballon bien sec car l'anhydride éthanoïque réagit violemment avec l'eau pour conduire à l'acide éthanoïque ; de plus l'eau formé peut hydrolyser l'ester. Précautions à prendre pour introduire l'anhydride éthanoïque et l'acide sulfurique concentré dans le ballon : travail sous hotte , port de gants, blouse et lunettes, ces liquides étant corrosifs et nocifs. Après 20 minutes de chauffage, on sort le ballon du bain-marie sans couper la circulation d'eau puis on introduit par le haut du réfrigérant 10 mL d'eau distillée destinés à hydrolyser l'excès d'anhydride acétique puis, quand l'ébullition cesse, 50 mL d'eau distillée glacée. Les cristaux d'aspirine précipitent dans le ballon. Après cristallisation complète, on filtre sur büchner, on rince les cristaux puis on les place à l'étuve à 80 °C pour les faire sécher. La masse expérimentale d'aspirine obtenue est : mexp = 10,8 g. L'équation de la réaction modélisant cette transformation est indiquée ci-dessous :
Données : Masses molaires : - de l'anhydride acétique : Manh. = 102 g/mol ; - de l'aspirine : Masp. = 180 g. mol-1 ;- de l'acide salicylique : Mac. = 138g .mol-1 Masse volumique de l'anhydride éthanoïque : r = 1,08 g.mL-1. Quantités de matière initiales (mol) : Anhydride acétique : masse (g) = volume (mL) * masse volumique ( g/mL) = 12*1,08 = 12,96 g n(mol)= m/ Manh. =12,96 / 102 = 0,127 mol. acide salicylique : n(mol)= m/ Mac =10,0 / 138 = 7,25 10-2 mol. d'après les coefficients de la réaction, 7,25 10-2 mol d'acide salicylique réagit avec 7,25 10-2 mol d'anhydride éthanoïque pour former 7,25 10-2 mol d'aspirine. Or initialement il y a 0,127 mol d'anhydride acétique, valeur supérieure à 7,25 10-2 mol : donc ce réactif est en excès. Calcul de la masse théorique mth d'aspirine : mth = nMasp. =7,25 10-2 *180 = 13,0 g. Calcul du rendement de cette transformation : mexp /mth = *100 = 10,8/13*100 = 83,1 %. Identification de l'aspirine synthétisée par CCM :
Le produit A conduit à deux taches sur le chromatogramme : A est un mélange contenant de l'aspirine et de l'acide salicylique.
L'indication 254 nm signifie : la longueur d'onde de la
radiation UV est 254 nanomètre. Les composés solides obtenus par synthèse organique ou extraits de substances naturelles sont souvent contaminés par de faibles quantités d’impuretés. La technique habituelle de leur purification est la recristallisation, basée sur leur différence de solubilité à chaud et à froid dans les solvants. La plupart des composés organiques fondent entre 50 et 300 °C. Le point de fusion (température de fusion) est un critère de pureté très utilisé : une substance solide pure présente un point de fusion bien net, le passage de l'état solide à l'état liquide se faisant sur un intervalle de température de moins de 1 °C. Par contre, un produit impur fond mal, sur un intervalle de température de plusieurs degrés, en passant par un état intermédiaire pâteux. La mesure du point de fusion d'un composé solide se fait à l'aide d'un appareil appelé "banc Köfler". Il s'agit d'une plaque chauffante, présentant un gradient de température (de 50 à 250 °C, pour l'appareil ci-dessous), aussi régulier que possible.
|
|||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||
|
|
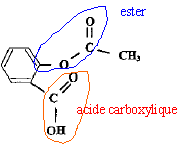 acide salycilique :
acide salycilique :