|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
|
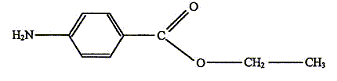
La benzocaïne (4-aminobenzoate d'éthyle) est le principe actif
de médicaments pouvant soulager la douleur, Par exemple, il est présent
dans une pommade qui traite les symptômes de lésions cutanées (brûlures
superficielles, érythèmes solaires). Dans la suite de l'exercice, la
benzocaïne sera notée E, sa formule semi-développée est : On se propose de préparer la benzocaïne en faisant réagir de l'acide 4-aminobenzoïque, noté ensuite HA et un composé liquide à température ambiante, l'éthanol. L'équation de la réaction est : HA + CH3-CH2OH = H2O + E. Mode opératoire : Première étape : estérification - dans un ballon de 100 mL, introduire une masse mHA = 1,30 g de HA, solide constitué de cristaux blancs et un volume V = 17,5 mL d'éthanol. Agiter doucement dans un bain de glace et ajouter peu à peu 2 mL d'une solution aqueuse concentrée d'acide sulfurique. - chauffer à reflux pendant une heure, puis laisser revenir le mélange à température ambiante. Deuxième étape : séparation de la benzocaïne - verser le mélange très acide contenu dans le ballon dans un bécher et y ajouter peu à peu une solution saturée de carbonate de sodium en mélangeant le tout jusqu'à obtenir une solution ayant un pH voisin de 9. On observe un dégagement gazeux et la formation d'un précipité (sulfate de sodium). - filtrer le mélange pour éliminer le précipité ; -placer le filtrat dans une ampoule à décanter, rincer le bécher avec 15 mL d'éther que l'on ajoute au contenu de l'ampoule, agiter l'ampoule et laisser décanter ; - récupérer la phase organique dans un erlenmeyer, rincer de nouveau la phase aqueuse avec 15 mL d'éther, laisser décanter et joindre la phase organique à celle déjà présente dans l'erlenmeyer ; - ajouter un peu de sulfate de magnésium anhydre au contenu de l'erlenmeyer, laisser au contact quelques minutes puis filtrer ; - évaporer le solvant de la phase organique sous hotte ; une huile apparaît qui se solidifie dans un bain de glace ; - filtrer sur büchner ; laver le solide obtenu à l'eau, le sécher ; - peser le solide obtenu. Troisième étape : vérification de la pureté du produit Afin de vérifier la pureté du produit préparé, on effectue une chromatographie sur couche mince, Tous les échantillons à étudier sont d'abord dissous dans l'éthanol. - réaliser les dépôts de gauche à droite dans l'ordre suivant : le dépôt 1 correspond à l'acide HA, le dépôt 2 à la benzocaïne pure, le dépôt 3 au solide obtenu à la fin de la deuxième étape ; - placer la plaque dans une cuve de chromatographie contenant l'éluant ; - après élution, sortir la plaque, repérer le front de solvant, sécher, révéler sous UV pour repérer les différentes taches. Le chromatogramme obtenu après révélation est fourni ci- après. 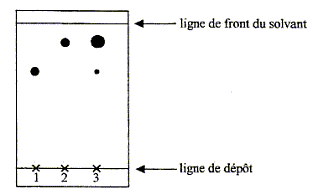 Données : Valeurs de pKa à 25°C : pKa(HA(aq)/A-(aq)) = 4,9 ; on rappelle que l'ion carbonate est une base. Quelques solubilités :
I- À propos de l'estérification.
II- Quelques justifications de certaines opérations du mode opératoire.
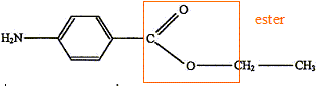
À propos de l'estérification. La benzocaïne est un ester. J'entoure le groupe caractéristique justifiant l'appartenance à cette famille :
Ecriture de l a formule semi-développée de l'acide HA :
L'estérification est une réaction lente, limitée par l'hydrolyse de l'ester. Quelques justifications de certaines opérations du mode opératoire. À propos de la première étape : L'éthanol, réactif en excès, permet de déplacer l'équilibre vers la formation de l'ester et d'augmenter le rendement ( calculé par rapport au réactif limitant). À propos de la deuxième étape : L'acide AH est un peu soluble dans l'éther ainsi que dans
l'éthanol ; par contre sa base conjuguée A- l'est très peu.
La phase aqueuse, la plus dense occupe la partie inférieure. À propos de la troisième étape. d'après le chromatogramme, le produit synthétisé à l'étape 2 présente deux taches : il s'agit donc d'un mélange. Les deux"étalons" notés 1 et 2 permettent d'identifier les deux constituants de ce mélange : AH ( en faible quantité au regard de la dimension de la tache) et la benzocaïne ( en quantité très importante).
|
|||||||||||||||||||||||||
|
|