|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||
| .
. |
||
|
||
|
|
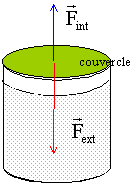
La fabrication des confitures se fait à partir d'un mélange de fruits et de sucre, chauffé autour de 120 degrés, sous la pression atmosphérique égale à 1,00 105. Les pots sont remplis à environ 1 cm du bord puis fermés, à cette température et sous cette pression. Ils refroidissent ensuite lentement.
corrigé Lorsque l'on ferme le pot, l' air emprisonné (masse constante de gaz ) est à 120°C et sous la pression atmosphérique. Au cours du refroidissement, son volume reste constant, il obéit donc à la relation p/T=cte ( loi de Charles ).On peut donc calculer la pression de l' air emprisonné lorsque la température est redescendue à 20°C. p0= 105 Pa ; T0 = 273+120 =393 K ; T1 = 273+20 = 293 K p1/T1 = p0 / T0 soit p1= p0 T1 / T0 = 105 *293/393= 7,5 104 Pa. Valeurs des forces pressantes F=p.S ( S= surface du couvercle en m² ; F en newton et pression en Pa). S= pR² avec R= 4 cm = 0,04 m S= 3,14*(4 10-2)2= 5,02 10-3 m² Fint = 7,5 104 * 5,02 10-3 = 376,5 N. Fext = 105 * 5,02 10-3 = 502 N.
La pression intérieure Pint est bien inférieure à la pression extérieure. Sur le couvercle la résultante F des forces pressantes est dirigée vers l'intérieur. F = (Pext - Pint) S = (105-0,75 104) 5,02 10-3 = 125,5 N Le couvercle est simplement posé sur le pot, la masse à poser sur le couvercle est telle que son poids soit égal à F M g =F soit M= F/g = 125,5 / 9,81 = 12,8 kg.
|
|
|
La pression atmosphérique au sol est de l’ordre de 105 Pa.
corrigé Aire du champ S = 50 x 100 = 5000 m² F = p x S = 105 *5000 = 5 108 N. F1 = p x S1 = 105 x 2 = 2 105 N. R = différence de pression* S1 = 103 x 2 = 2 103 N. Impossible à compenser manuellement. Cela reviendrait à soulever une masse M d'environ M = 2000 / 9,8 = 204 kg posée sur le sol ! |
||
|
Un ballon ne peut pas dépasser un volume de trois litres sans éclater. On introduit dans ce ballon deux litres d'hélium He à 20° C à une pression de 1,013 105 Pa.
Données : M(He)=4,0 g.mol-1 ; R=8,31 J.K-1mol-1. corrigé PV= nRT ; n= PV/(RT) avec T= 273+20= 293K et V= 2 10-3 m3. n= 1,013 105*2 10-3/(8,31*293)=0,083 mol. masse (g) = masse molaire (g/mol) * Qté de matière (mol) = 4*0,083 = 0,33 g. Le ballon éclate lorsque son volume atteint 3 L. La presion du gaz sous la cloche diminue : pour une masse de gaz parfait constante, à température constante PV= Cte P1V1=P2V2 soit P2 = P1V1/V2=1,013 105*2/3 =6,75 104 Pa. PV= nRT ;V= nRT/P avec T= 273+15=288 K ; P=8,2 104 Pa V=0,083*288*8,31/8,2 104 =2,4 10-3 m3 = 2,4 L valeur inférieure à 3L : le ballon n'éclate pas.
|
||
|
Trois flacons de volume V1=6,0 L, V2=4,0 L, V3=2,0 L sont reliés par l'intermédiaire de tuyaux de volume négligeable, munis de robinets. Au départ, les robinets R1 et R2 sont fermés. Seul le flacon de volume V1 contient du gaz sous la pression P1=3,0.105 Pa, les 2 autres flacons étant vides. Le gaz est supposé parfait et sa température est constante pendant l'expérience et égale à 20°C.
corrigé volume total des deux flacons en communication: 10 L = 0,01 m3. température et qté de matière restent constantes donc PV= Cte. P1V1 = P2(V1+V2) soit P2 =P1V1 / (V1+V2) =3 105 *6/10 = 1,8 105 Pa. de même lorsque les deux robinets sont ouverts ( les 3 flacons communiquent) P3 = P1V1 / (V1+V2+V3) =3 105 *6/12 = 1,5 105 Pa. Volume et quantité de matière sont constantes P3/T3 = P1/T4 soit T4 = P1/P3 * T3 = 3/1,5*(273+20) = 2*293 = 586 K. |
||
|
Un vase est rempli d'eau salée jusqu'a une hauteur h=11 cm (masse volumique r=1360 kg/m3).
corrigé pression : r gh = 1360*9,81*0,11 =1,47 103 Pa. reau gheau=1,47 103 d'où heau=1,47 103/(reau g)=1,47 103/(1000 *9,8)= 0,15 mètre d'eau. force pressante (N) = pression (Pa) * surface (m²) =1,47 103 *10-3 =1,47 N. volume d'eau salée (m3) = hauteur (m) * section (m²)=0,11* 10-3 m3= 1,1 10-4m3 masse d'eau salée( kg) = masse volumique ( kg/m3) * volume (m3) =1360*1,1 10-4 =0,15 kg poids correspondant (N) = masse (kg) * g = 0,15*9,81 =1,47 N. la force pressante
exercée sur la membrane est égale au poids de la colonne liquide.
|
||
|
Masse molaire argon : 39,9 g/mol corrigé Qté de matière et volume restent constants donc P1/T1 = P2/T2 soit P2 = P1*T2 / T1 avec T1= 273 K et T2= 273+25=298 K P2 =1,8*298/273 = 1,96 bar. Qté de matière d'argon n= PV/RT avec T= 273+65=338 K ; V= 8 10-5 m3 ; n= 105*8 10-5 /(8,31*338)=2,85 10-3 mol. masse (g) = masse molaire (g/mol) * Qté de matière (mol) = 39,9*2,85 10-3 =0,114 g. masse volumique (g/cm3) = masse (g) / volume (cm3)=0,114/ 80 = 1,42 10-3 g/cm3 = 1,42 kg/m3. |
||
|
A 20°C et sous 101.3kPa, l'éther, de formule C4H10O, est un liquide. Sa masse volumique vaut alor 0,71g.cm-3
C: 12 ; H : 1 ; O: 16 g/mol ; R= 8,31 J K-1 mol-1. corrigé masse molaire éther : M= 4*12+10+16= 74 g/mol volume d'une mole de liquide (mL)= masse d'une mole (g) / mase volumique (g/mL)= 74/0,71 = 104,2 mL. volume d'une mole de gaz : V= nRT/P avec n=1 ; T=273+34= 307 K ; P= 1,013 105Pa V= 8,31*307/1,013 105= 2,52 10-2 m3/mol = 25,2 L/mol. masse volumique du gaz : masse (g) / volume (L) = 74/25,2 = 2,94 g/L = 2,94 10-3 g/mL = 2,94 kg m-3. |
||
|
Un tube barométrique est retourné dans une cuve de mercure enfermant à son extrémité un gaz rare. La hauteur de la colonne de mercure est de 70,5 cm et la pression atmosphérique est de 76,5 cm de mercure. Quel est la pression du gaz rare dans le tube ? corrigé On considère un point situé dans un plan horizontal à la surface de contact mercure air : la pression en ce point est égale à la pression de l'air. La pression en ce point est égale à la pression due à la colonne de mercure ajouté à celle due au gaz qui est au dessus du mercure. 76,5 = 70,5 + P gaz P gaz = 6 cm de mercure soit en pascal : rmercure h g = 13600 * 0,06 * 9,8 = 8000 Pa. |
||
|
|