1. L'étiquette d'un flacon d'acide méthanoïque est partiellement effacée. La concentration molaire en soluté apporté est C1= 7,3 10 exposant -3 mol/L ou C2= 7,3 10 exposant -2 mol/L. La mesure du pH à 25° donne pH=3,0.
- Ecrire la réaction entre l'acide méthanoïque et l'eau.
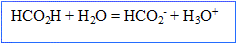
- La transformation entre l'acide méthanoïque et l'eau est-elle totale ? Justifier.
Si la transformation est ( molécule HCOOH entierement ionisée) alors : pH= -log C1 ou bien pH= -log C2
pH= - log(7,3 10^-3 )= 2,1 ou bien pH= - log(7,3 10^-2 )= 1,1.
La valeur mesurée est bien supérieure aux valeurs calculées dans cette hypothèse : donc la transformation entre l'acide méthanoïque et l'eau est .
- Donner l'expression de la constante d'acidité du couple acide méthanoïque / ion méthanoate en fonction du pH et de la concentration C.
Calculer la concentration en soluté apporté C si pKa= 3,8.
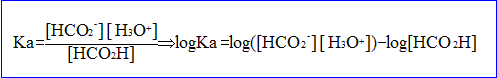
La solution est électriquement : [ion méthanoate]=[ion oxonium]
conservation de l'élément : [HCOOH] + [ion méthanoate]= C
[HCOOH] + [ion oxonium]= C ; [HCOOH] = C- [ion oxonium]
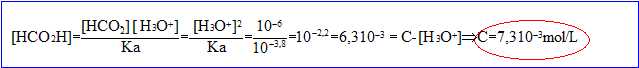
2. On ajoute à la solution précédente quelques gouttes d'hydroxyde de sodium. Le pH de la solution S' ainsi obtenue donne pH=5 à 25°C.
Quelle est l'espèce du couple étudié qui prédomine dans S' ?
A pH à pKa ( pka=3,8 dans ce cas) la forme base conjuguée, l'ion méthanoate, prédomine.
- Ecrire l'équation de la réaction qui a au lieu lors de l'ajout de l'hydroxyde de sodium.
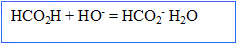
- Exprimer puis calculer la constante k associée à cette réaction. La transformation entre l'acide méthanoïque et l'eau est-elle totale ?
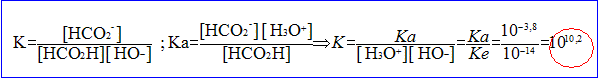
La constante K est très grande, donc la transformation est .
3. Pour déterminer la concentration réelle en soluté apporté de la solution S d'acide méthanoïque, on introduit dans un bécher un volume V=20 mL de la solution S et quelques gouttes d'indicateur coloré. On verse progressivement dans ce bécher une solution d'hydroxyde de sodium de concentration Cb= 0,020 mol/L. Le virage de l'indicateur a lieu pour un volume d'hydroxyde de sodium ajouté égal à Véqui= 7,3 mL.
- Définir l'équivalence acido-basique puis calculer la concentration réelle de la solution S.
A l'équivalence, les quantités de matière des réactifs mis en présence sont en proportions .
CV= Cb Véqui soit C= CbVéqui / V = 0,02*7,3/20 = 7,3 10 exposant -3 mol/L..
3. Pour déterminer la concentration réelle en soluté apporté de la solution S d'acide méthanoïque, on introduit dans un bécher un volume V=20 mL de la solution S et quelques gouttes d'indicateur coloré. On verse progressivement dans ce bécher une solution d'hydroxyde de sodium de concentration Cb= 0,020 mol/L. Le virage de l'indicateur a lieu pour un volume d'hydroxyde de sodium ajouté égal à Véqui= 7,3 mL.
- Définir l'équivalence acido-basique puis calculer la concentration réelle de la solution S.
A l'équivalence, les quantités de matière des réactifs mis en présence sont en proportions .
CV= Cb Véqui soit C= CbVéqui / V = 0,02*7,3/20 = 7,3 10 exposant -3 mol/L..
CV= Cb Véqui soit C= CbVéqui / V = 0,02*7,3/20 = 7,3 10 exposant -3 mol/L..
3. Pour déterminer la concentration réelle en soluté apporté de la solution S d'acide méthanoïque, on introduit dans un bécher un volume V=20 mL de la solution S et quelques gouttes d'indicateur coloré. On verse progressivement dans ce bécher une solution d'hydroxyde de sodium de concentration Cb= 0,020 mol/L. Le virage de l'indicateur a lieu pour un volume d'hydroxyde de sodium ajouté égal à Véqui= 7,3 mL.
- Définir l'équivalence acido-basique puis calculer la concentration réelle de la solution S.
A l'équivalence, les quantités de matière des réactifs mis en présence sont en proportions .
CV= Cb Véqui soit C= CbVéqui / V = 0,02*7,3/20 = 7,3 10 exposant -3 mol/L.