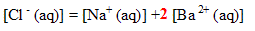On mélange V= 100 mL de solution de sulfate de sodium 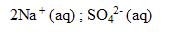 de concentration molaire apporté C= 2,0 10 exposant -3 mol/L et V'= 50 mL de solution de chlorure de baryum
de concentration molaire apporté C= 2,0 10 exposant -3 mol/L et V'= 50 mL de solution de chlorure de baryum 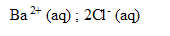 de concentration molaire en soluté apporté C'= 5,0 10 exposant -3 mol/L.
de concentration molaire en soluté apporté C'= 5,0 10 exposant -3 mol/L.
1. On observe la formation d'un précipité. Quels sontt son nom et sa formule ?
précipité de de baryum 
2. Etablir le tableau d'avancement.
Quantité de matière initiale (mol) en ion baryum et sulfate :

n( ion baryum) = C'V' = 5 10^ -3 * 50 10^ = 2,5 10^ -4 mol.
n(ion sulfate) = CV= 2 10^ -3 * = 2 10^ -4 mol
| avancement (mol) | 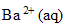 | +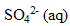 | = |
| initial | 0 | 2,5 10 exposant-4 | 2 10 exposant -4 | 0 |
| en cours | X | 2,5 10^-4 -X | 2 10^ -4 -X | X |
| fin | Xmax | 2,5 10^-4 -Xmax | 2 10^ -4 -Xmax | Xmax |
Si l'ion baryum est en
: 2,5 10^-4 -Xmax = 0 soit Xmax = 2,5 10^-4 mol
Si l'ion
est en défaut : 2 10^ -4 -Xmax = 0 soit Xmax = 2,0 10^-4 mol
On retient la plus
valeur
3. En déduire la masse du précipité. Ba = 137 ; S= 32 ; O= 16 g/mol

masse molaire du sulfate de baryum : 137 + 32 + 4*16 =
g/mol.
masse du précipité : 233 * 2 10 exposant -4 =
10 exposant -2 g
4. Quels sont les ions présents dans l'état final ? Quels sont leurs concentrations ?
ion
:
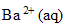
5 10^-5 mol.
ion
:
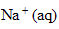
fois CV = 2* 2 10^-3*0,1 = 4 10^-4 mol
ion
:
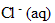
fois C'V' = 2* 5 10^-3*0,05 =5 10^-4 mol
volume total du mélange : 100+50 = 150 mL =
L.

[ion baryum]= 5 10^ -5 / 0,15 =
10 exposant -4 mol/L
[ion sodium]= 4 10^-4 / 0,15 =
10 exposant -3 mol/L
[ion chlorure]= 5 10^ -4 / 0,15 =
10 exposant -3 mol/L
5. Vérifier l'électroneutralité de la solution :