Dans un volume V= 5mL de solution de nitrate d'argent, de concentratrion molaire en soluté apporté C=0,20 mol/L, on plonge un fil de cuivre de masse m=0,26 g.
Le cuivre se recouvre d'argent et la solution devient bleue : formation d'ion cuivre (II).
1. Quels sont les ions présents dans la solution de nitrate d'argent ?
ion argent 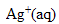 et ion nitrate
et ion nitrate 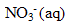
2. Ecrire l'equation-bilan de la réaction. Quels sont les ions spectateurs ?
Les ions nitrate
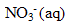
sont spectateurs.
3. Calculer les quantités de matière initiales des réactifs.M(Cu)=63,5 g/mol.
n(Ag+) (mmol)= concentration (mol/L) * volume de la solution (mL )= 0,2*5 =
mmol.
n( cuivre) mmol = masse (mg)
par masse molaire (g/mol) = 260/63,5 =
mmol
4. Apartir d'un tableau d'avancement déterminer :
- L'avancement maximal, le réactif limitant.
- La composition dans l'état final en moles.
- La concentration molaire finale des ions cuivre(II).
si le cuivre est en défaut : 4,1-Xmax=0 soit Xmax= 4,1 mmol
si l'ion argent est en défaut, 1-2Xmax=0 soit Xmax =
mmol
On retient la plus
valeur.
| avancement (mmol) | Cu(s) | +2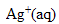 | =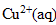 | +2Ag(s) |
| 0,5 | 4,1-0,5=3,6 | 1-2*0,5=0 | 0,5 | 2*0,5=1 |
concentration (mol/L= quantité de matière (mmol) / volume solution (mL)
concentration en ion cuivre II = 0,5/5 =
mol/L