On dissout une mole d'acétate d'ammonium dans un litre d'eau pure. L'acétate d'ammonium est un solide qui se dissocie en ions 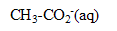 et
et 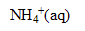 .
.
1.Quelles espèces chimiques contient l'eau pure ?
molécules d'eau, ion  , ion
, ion 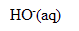
2. Quelles espèces chimiques sont présentes dans la solution après dissolution de ce solide.
molécule d'eau,  ,
, 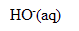 , ion
, ion 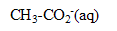 , ion
, ion 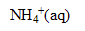
3. Identifier les acides et les bases présentes en solution.
l' se comporte comme un acide ou comme une base,  est un ,
est un , 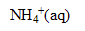 est un ,
est un , 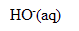 est une ,
est une , 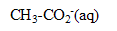 est une .
est une .
4. Quels couples couples acide-base sont présents en solution ?
| acide | base conjuguée |
| eau H2O | 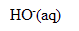 |
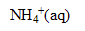 | 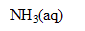 |
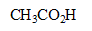 | 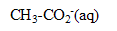 |
 | eau H2O |
5. Le pH d'équilibre de la solution obtenue est de 7. En dissolvant une mole de chlorure d'ammonium dans l'eau pure, le pH obtenu est de 4,6.
- Calculer l'avancement de la réaction acide-base suivant la dissolution du chlorure d'ammonium et le pKa de l'acide correspondant.
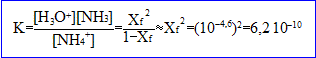
- Quel est cet avancement dans le cas de l'acétate d'ammonium ?
| avancement (mol) | 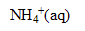 | +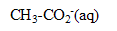 | =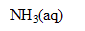 | +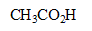 |
| initial | 0 | 1 | 1 | 0 | 0 |
| en cours | X | 1-X | 1-X | X | X |
| équilibre (fin) | Xf | 1-Xf | 1-Xf | Xf | Xf |
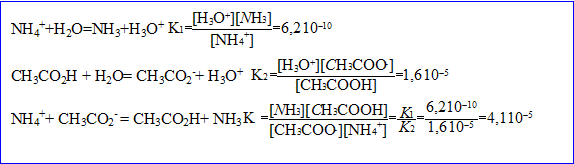
Hypothèse : 1-Xf voisin de Xf d'où K= Xf ² soit Xf= racine carrée (K)= racine carrée(4,1 10^-5)=
10^(-3)mol
L'hypothèse est bien vérifiée.