|
d'après concours manipulateur électroradiologie médicale Lyon 2005 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|
Une onde électromagnétique est caractérisée par sa longueur d'onde dans le vide l 0 (m) ou sa fréquence n ( Hz). l'énergie E (J) des photons associés à une onde électromagnétique peut se calculer par les relations E= h n = hc/l 0 où h est la constante de Plank. h= 6,62 10-34 J s.
corrigé h n = hc/l 0 donne n = c/l 0 soit l 0=c/n avec c= 3 108 m/s, célérité de la lumière dans le vide ou dans l'air. n = c/l 0= 3 108 / 400 10-9 = 3 108 / 4 10-7 = 3/4 1015 = 7,5 1014 Hz. l 0 = 400 nm : ondes située à la limite des UV et de la couleur violette du domaine visible. Les ultrasons ne sont pas des ondes électromagnétiques ( par exemple, pas de propagation dans le vide). E=h n , donc l'énergie augmente si la fréquence augmente. E= hc/l 0 donc l'énergie augmente si la longueur d'onde l 0 diminue. E=h n = 6,62 10-34 *1,6 1015 =6,62 *1,6 10-19 J puis diviser par 1,6 10-19 pour obtenir l'énergie en électronvolts. E= 6,62 eV.
|
||||||||||||||||||||||||
|
Données
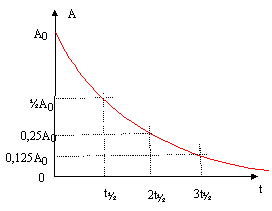
corrigé noyau de tellure 131 : 52 protons et 131-52 = 79 neutrons Des noyaux isotopes ne se différentient que par leur nombre de neutrons : 13455Cs et 13755Cs la particule b- est un électron soit 0-1e 13153I --> AZX + 0-1e conservation de la charge : 53=Z-1 soit Z= 54 et X est identifié avec le Xenon Xe conservation du nombre de nucléons : 131 = A+0 soit A = 131. L'activité, exprimée en becquerel (Bq) est le nombre de désintégrations par seconde. t½l= ln2 : la demi-vie t½ dépend de la constante radioactive l.
2005-1986 = 19 années. La demi-vie de l'iode 131 étant de 8 jours, l'activité de ce dernier est pratiquement nulle en 2005. Par contre la demi-vie du césium 137 étant de 30 ans, l'activité initiale de ce dernier n'est pas encore divisée par deux en 2005 : on peut donc mesurée l'activité du césium 137, 19 ans après la catastrophe.
|
|||||||||||||||||||||||||
|
L'eau de Javel est une solution aqueuse contenant entre autres des ions chlorure Cl- et des ions hypochlorite ClO-. Ces ions interviennent dans les couples redox Cl2/Cl- et ClO-/ Cl2.
corrigé Cl2/Cl- : Cl2 représente la forme oxydante du couple et Cl- la forme réduite. 2Cl- = Cl2 + 2e- oxydation de l'ion chlorure ClO-/ Cl2 : ClO- représente la forme oxydante du couple et Cl2 la forme réduite. 2 ClO- + 2e- + 4 H+= Cl2 + 2 H2O. réduction de l'ion hypochlorite Le dichlore peut soit jouer le rôle de réducteur ou le rôle d'oxydant. 2 ClO- + 2Cl- + 4 H+= 2Cl2 + 2 H2O. dégagement de dichlore, gaz toxique et irritant ( voir mortel) pour les poumons.
|
|||||||||||||||||||||||||
|
Une solution aqueuse contenant de l'acide formique HCOOH et l'ion formiate HCOO- a un pH de valeur 4,8. On donne le pKa du couple (HCOOH/ HCOO- )= 3,75.
corrigé A pH supérieur à pKa, la forme basique du couple acide base prédomine. L'ion formiate prédomine à pH= 4,8. Si [HCOOH]=[HCOO-] alors pH= pKa.
|
|||||||||||||||||||||||||
|
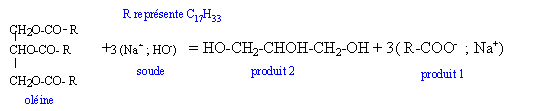
I Préparation d'un savon . 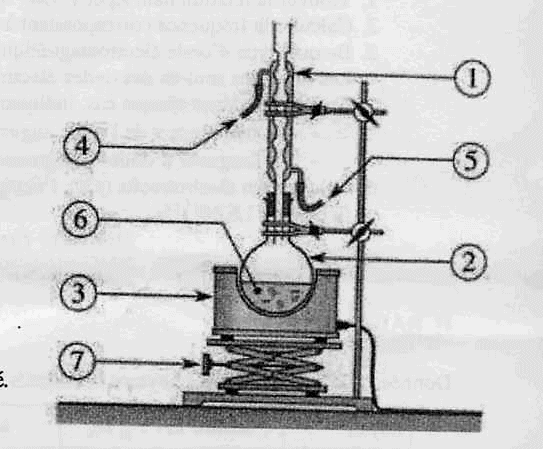 1ère étape : On chauffe pendant 30 min un mélange composé de 0,02 mol d'huile de soja ( essentiellement constituée d'oléine), 0,045 mol d'hydroxyde de sodium (soude), 2 mL d'éthanol et quelques grains de pierre ponce. 2ème étape : On laisse refroidir le mélange quelques minutes et on le transvase dans un bécher contenant une solution aqueuse concentrée de chlorure de sodium ( eau salée). 3è étape : Le précipité obtenu est filtré, rincé à l'eau salée, séché puis pesé. La masse obtenue est m= 9,45 g.
corrigé montage " chauffage à reflux" La saponification est lente à température ambiante : en travaillant à chaud on augmente la vitesse de la réaction. 1 : colonne Vigreux ou réfrigérant droit ; 2 : ballon ; 3 : chauffe ballon ; 7 : élévateur à croissillons 4 : tube de sortie de l'eau ; 5 : tube d'arrivée de l'eau ; 6 : mélange réactionnel La pierre ponce régularise l'ébullition. Le savon insoluble dans l'eau salée saturée, précipite : relargage du savon. 1 : oléate de sodium ou savon ; 2 : glycérol
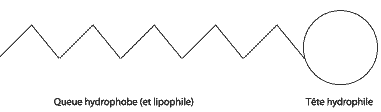
si la soude est en défaut :0,045-3xmax = 0 soit xmax = 0,015 mol la soude constitue le réactif limitant. rendement = Qté de matière réellement obtenue /Qté de matière théorique maximale de savon * 100 ou masse réellement obtenue / masse maximale théorique de savon * 100 masse théorique (g) =Qté de matière théorique maximale de savon (3 xmax en mol) * masse molaire ( g/mol)de l'oléate de sodium. Représentation schématique d'une molécule de savon :
La queue hydrophobe correspond à la longue chaine carbonée C17 H33 ; la tête hydrophile correspond au groupe COO-. hydrophobe signifie "qui a de l'aversion pour l'eau" (qui n'aime pas l'eau). hydrophile signifie "qui a de l'affinité pour l'eau" (qui aime l'eau). la longue chaine carbonée lipophile peut se lier à une salissures grasse.
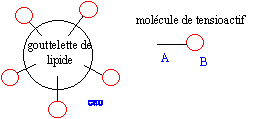
cet assemblage constitue une micelle. La partie hydrophile du savon peut se lier à l'eau. Les molécules de savon se collent facilement à la tache par leur queue hydrophobe" "Lorsqu'on frotte la tache, l'huile se décolle du tissu... ... et se
retrouve entourée de molécules de savon, enfermée dans une micelle qui
ne se colle pas au tissu puisque sa surface est hydrophile".
|
|||||||||||||||||||||||||
| |
|||||||||||||||||||||||||
|
|