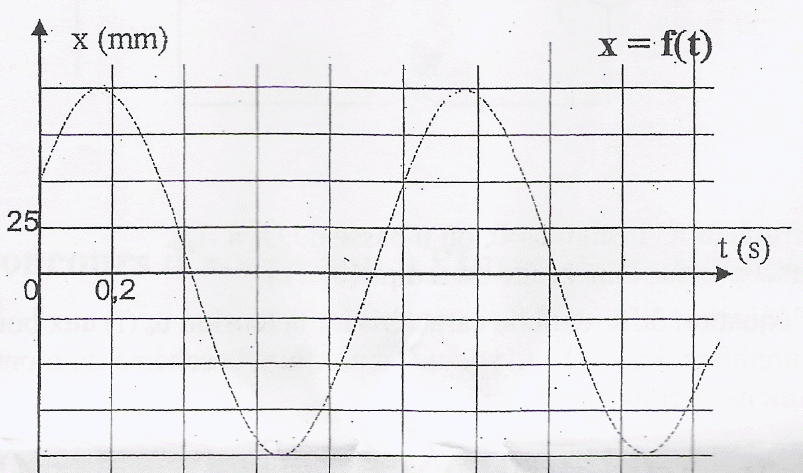|
datation : potassium argon ; oscillateur mécanique ; condensateur ; sulfate de baryum ; pile électrique ; ester ; caféine ; vert de malachite. sans calculatrice ; d'après concours kiné Limoges 2005 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||
| .
. |
||||||||||||||||||||
|
||||||||||||||||||||
|
Un joueur de pétanque lance une boule de masse m d'un point A situé à une hauteur OA= 0,7 m au dessus du sol. a= 60 °. La boule atteint le sol horizontal à une distance d= 10 m de la verticale du point A. 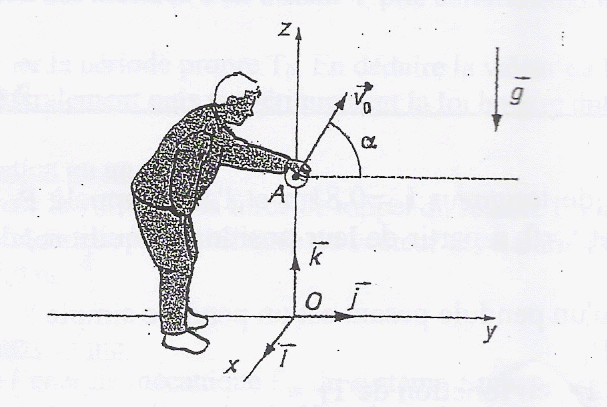
g= 10 m/s² ; cos 60 = 0,5 ; tan 60 = 1,73 ; racine carrée (1000)= 31,5.
corrigé 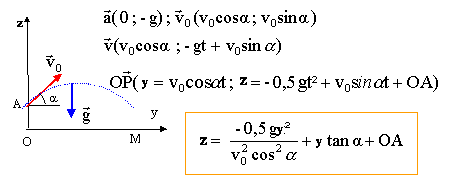
Au point d'impact y=0 et x=d=10 m. 0= -0,5*10*100/(v0²*0,5²)+ 10 *1,73 + 0,7 0= -2000/v0² + 18 soit v0² = 1000/9 ; v0 =31,5 / 3 = 10,5 m/s.
|
||||||||||||||||||||
|
Le potassium K( Z= 19 et A= 40) est radioactif et se désintègre en donnant de l'argon Ar( Z= 18 ; A= 40)
l= constante radioactive du potassium 40 demi vie du potassium 40 : t½= 1,5 109 ans ln 2 = 0,7 ; ln 3 = 1,1 ; 4/7 voisin 0,6. corrigé 4019K-->4018Ar + 01e ( positon) conservation de la charge : 19 = 18 + 1 conservation du nombre de nucléons : 40 = 40 +0 loi de décroissance radioactive : NK= N0 exp(-lt) où N0 = NKexp(lt) en conséquence NAr = N0-NK=N0 (1-exp(-lt))
NAr=½NK ; (N0-NK)=½NK ;(N0-NK) /NK = 0,5 soit N0/NK = 1,5. d'après la loi de décroissance radioactive :NK/ N0 = exp(-lt) ln(NK/ N0 )= -lt ; N0 /NK =lt d'où : lt = ln1,5 avec lt½=ln2 soit t = ln1,5 / ln2 *t½=
(ln3-ln2)/ln2*t½= (1,1-0,7)/0,7*1,5
109 =4/7 *1,5 109 =0,6*1,5
109 = 0,9 109
ans.
|
||||||||||||||||||||
|
Deux pendules simples, l'un appelé P1 de longueur L1= 0,81 m et l'autre appelé P2 de longueur L2 = 2,56 L1, sont lancés au même moment à partir de leur position d'équilibre dans le même sens noté "+".
corrigé Un solide ponctuel,de masse m, accroché à une fil inextensible de masse négligeable, constitue un pendule simple. T1 = 2p (L1/g)½= 2p (0,81 / 10 )½=2p 0,81½ / 10 ½=2p * 0,9 /p = 1,8 s. T2 = 2p (L2/g)½ ;T2 /T1 =(L2/L1)½ ;T2 =T1 (L2/L1)½ =T1 (2,56)½ =1,6T1. Lorsque le pendule P1 décrit n périodes, alors le pendule P2 décrit n' périodes : les deux pendules passent alors pour la première fois , dans le même sens "+" à la position d'équilibre. n T1 = n'T2 soit n T1 = n'*1,6 T1 ; n= 1,6 n' avec n et n' entiers n'=5 et n=8 ; le temps vaut : 1,8*8 = 14,4 s. |
||||||||||||||||||||
|
Un mobile autopoerteur de masse m =500 g se déplace sur une table horizontale. Il est accroché à deux ressorts métalliques identiques, de masse négligeable, de longueur au repos l0, et de constante de raideur k. A1 et A2 sont des points fixes. On admet que le dispositif est équivalent à un mobile autoporteur de masse m fixé à un ressort unique de constante de raideur K= 2k dont l'autre extrémité est fixe. 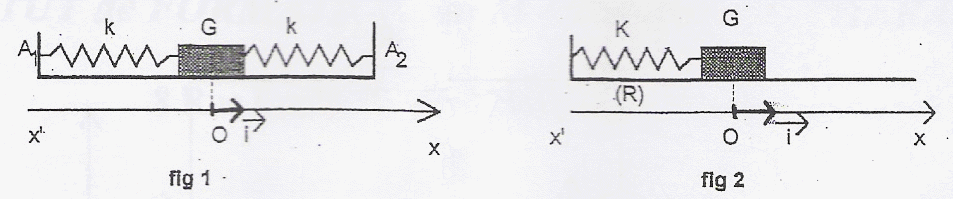
corrigé période T0 : 5 divisions soit 5 *0,2 = 1 s. T0 = 2 p (m/(2k))½ soit 2k = 4 p ²m /T²0 =4*10*0,5 / 1 =20 soit k = 10 N/m. x(t) = xmax sin( w t+j) avec xmax = 100 mm = 0,1 m w =2 p /T0 =2 p rad/s ; j : phase à l'origine des temps. x(0) = 50 mm = 0,05 m (lecture graphe) ;x(0) = 0,1 sinj d'où sin j =0,05/0,1 = 0,5 ; j=30° ou 0,52 rad. x(t) = 0,1 sin (2
p
t +p
/6).
force de rappel : F= - 2k x i = -2k 0,1 sin (2 p t +p /6) i = -2 sin (2 p t +p /6) i. valeur de la force de rappel à t = 1 s : 2 sin (2 p +p /6) = 2 sin(p /6) = 1 N. l'accélération est la dérivée seconde de x(t) par rapport au temps : x'(t) = 0,1*2p cos (2 p t +p /6) x"(t) = -0,1*(2p)²sin (2 p t +p /6) = - (2p)² x(t) à t = 1 s : : x"(1) = -0,1
*4p2
sin(2 p
t +p
/6) = -0,1*4*10 sin(p
/6) = -4 *0,5 = -2
m/s².
En absence de frottement, l'énergie mécanique reste constante : Em = ½(2k) x²max = 0,5*20*0,1² =0,1 J. Au passage à la position d'équilibre, l'énergie mécanique est sous forme cinétique ( la vitesse est alors maximale) 0,1 = ½mV²max soit V²max =0,2 / m = 0,2 /0,5 = 0,4 ; Vmax = 0,63 m/s. Ep(t=1) = ½(2k)x²(t=1) = k x²(t=1) = 10 x²(t=1) = 10 *0,1² sin² (2 p +p /6)= 0,1 sin²(p /6) = 0,1*0,5²= 0,025 J. vitesse à t= 1 s : x'(t) = 0,1*2p cos (2 p +p /6) =0,1*2p cos (p /6)= 0,1*2p * 0,87 = 0,55 m/s. La vitesse correspond à la pente ( coefficient directeur) de la tangente à la courbe à la date t= 1 s : ce coefficient directeur est positif, donc la vitesse à le sens du vecteur i.
|
||||||||||||||||||||
|
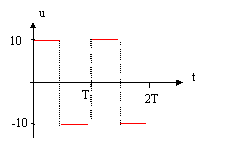
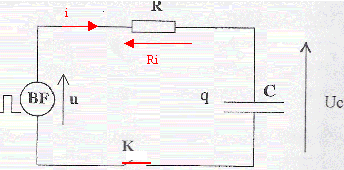
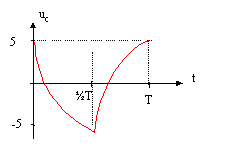
On réalise le montage ci-dessous permettant d'étudier la charge et la décharge d'un condensateur ( C= 10 mF; R= 10 kW). Le générateur basse fréquence délivre une tension u alternative crénau, d'amplitude U0 = 10V et de période T. Initialement l'interrupteur K est ouvert et la tension aux bornes du condensateur est + 5 V. 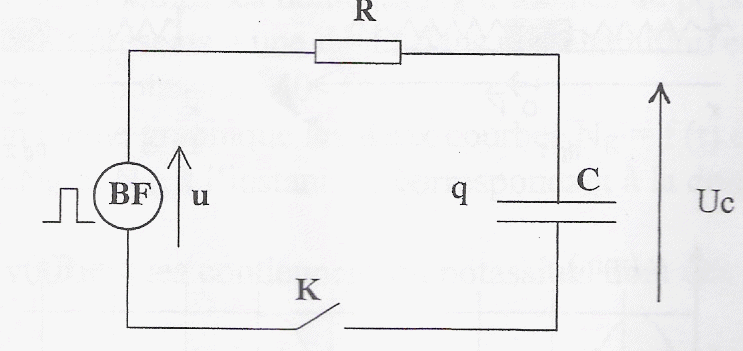
Ri + uc= u = -U0 avec i= dq/dt = d(Cuc)/dt = Cduc/dt = Cu'c. d'où RCu'c + uc= -U0. uc= -U0+ 1,5 U0 exp(-t/(RC)) dériver par rapport au temps : u'c=- 1,5 U0 / (RC)exp(-t/(RC)) repport dans l'équation différentielle : - 1,5 U0 exp(-t/(RC)) -U0+ 1,5 U0 exp(-t/(RC)) = - U0 vérifiée pour toute valeur de t. uc(t=0 ) =-U0+ 1,5 U0 =
0,5 U0 = 0,5*10 = 5 V ( condition initiale
vérifiée)
uc= -½U0= -U0+ 1,5 U0 exp(-T/(2RC)) avec RC= 104*10-5 = 0,1 s. -0,5 = -1 + 1,5 exp (-T/ 0,2) ; 0,5 / 1,5 =exp (-T/ 0,2) ; 1/3 =exp (-T/ 0,2) ln 3 =T/ 0,2 soit T= 0,2 ln3 = 0,2*1,1
= 0,22
s.
d'où RCu'c + uc= U0. uc= -U0- 1,5 U0 exp((T-2t)/(2RC)) valeur de uc à la date t= 0,5 T : uc(t= 0,5 T)= U0- 1,5 U0 exp((T-T)/(2RC)) =U0- 1,5 U0 = -½U0. valeur de uc à la date t= T : uc(t= T)= U0- 1,5 U0 exp((T-2T)/(2RC)) =U0- 1,5 U0 exp((-T)/(2RC)) avec :T/(2RC) =0,22 / (0,2) = 1,1 s. uc(t= T)= U0- 1,5 U0 exp(-1,1) =U0- 1,5 U0(1/3) = ½U0. |
||||||||||||||||||||
|
Le sulfate de baryum BaSO4 est un composé très peu soluble dans l'eau.
corrigé BaSO4 (s) = Ba2+(aq) + SO42-(aq) K= [Ba2+][SO42-]=10-10 [Ba2+]=[SO42-]= K½= 10-5 mol/L. état initial : on ajoute à la solution saturée une goutte d'acide sulfurique donc des ions sulfates ; en conséquence le quotient initial Qr, i devient supérieur à K : la transformation évolue donc dans le sens indirect, précipitation du solide BaSO4.
|
||||||||||||||||||||
|
Dans un bécher on mélange 20 mL de solution de nitrate d'argent Ag+ ; NO3- de concentration 0,1 mol/L avec 20 mL d'une solution de nitrate de cuivre Cu2+ ; 2NO3- de concentration 0,05 mol/L. La constante d'équilibre associée à la réaction 2Ag+ (aq)+ Cu(s) = 2Ag(s) + Cu2+(aq) vaut K= 2 1015. Masse atomique molaire (g/mol ): Cu : 64 ; Ag : 108. 1 faraday = 105 C.
corrigé Qri = [Cu2+]i/[Ag+]i2avec [Cu2+]i = 0,05*20/40 = 0,025 mol/L et [Ag+]i = 0,1*20/40 = 0,05 mol/L Qri =0,025/0,05²= 250/25=10. Qri <K donc évolution dans le sens direct. Qr éq = K = [Cu2+]éq/[Ag+]éq2 [Ag+]éq2 = [Cu2+]éq//K= 0,05 / 2 1015 = 25 10-18 mol/L ; [Ag+]éq = 5 10-9 mol/L l'ion argent a pratiquement disparu ; ce dernier
constitue le réactif limitant.
oxydation à l'anode
négative : Cu(s) = Cu2+ (aq) +
2e-. Or Ag+ (aq) + e- = Ag (s) d'où la quantité de matière d'électrons : 10-3 mol La charge, en valeur absolue, d'une mole d'électrons vaut 105 C Qté d'électricité ayant traversé le conducteur : 10-3*105 = 100 C.
|
||||||||||||||||||||
|
Le géraniol est un alcool primaire de formule brute C10H18O. On réalise la synthèse de l'acétate de géranyle à partir du géraniol et de l'anhydride acétique. On dispose d'une masse m1 = 1,54 g de géraniol et d'un volume V= 10,2 mL d'anhydride acétique ( r= 1,08 g)mL). Masse molaire en g/mol : M( géraniol) = 154 ; M( ester) = 196 ;M( acide acétique) = 60
corrigé C10H18O + (CH3-CO)2O --> CH3-CO2-C10H18 + CH3-CO2H réaction totale et rapide avec l'anhydride, lente et limitée avec l'acide acétique. masse des produits = masse des réactis soit à partir d'une mole d'alcool et d'une mole d'anhydride : M( anhydride) + M( géraniol) =M( ester) +M( acide acétique) M( anhydride) = - M( géraniol) +M( ester) +M( acide acétique) = -154+196+60 = 102 g/mol. n( anhydride) = masse (g) / masse molaire avec masse (g) = masse volumique (g/mL) * volume (mL) n( anhydride) = r V/M(anhydride) = 1,08*10,2/102 = 0,108 mol. n ( géraniol) = m1/ M( géraniol) = 1,54 / 154 = 0,01 mol. l'alcool est le réactif limitant : xmax = 0,01 mol on peut obtenir théoriquement 0,01 mol d'ester soit : 0,01*196 = 1,96 g.
|
||||||||||||||||||||
|
La caféine est une base dont le couple acide base sera noté BH+/B. On dissout 0,01 mol de caféine dans de l'eau distillée de façon à avoir un volume V=500 mL de solution. La conductivité de la solution vaut s = 40 mS m-1. Conductivité molaire ionique en mS m² mol-1 : lBH+ = 0 ; lHO- = 20 ; Ke = 10-14 et log 2 = 0,3.
corrigé B +H2O = BH+ + HO-. s = lBH+ [BH+]+ lHO- [HO-] avec [HO-] =[BH+] s = (lBH+ +lHO- ) [HO-] ; [HO-]= s / (lBH+ +lHO- ) 40 / 20 = 2 mol m-3 = 2 10-3 mol/L soit n( HO-) =xfin = 2 10-3 * 0,5 = 10-3 mol. x max = 0,01 mol soit t = xfin / x max = 10-3 / 10-2 = 0,1 . [H3O+]=Ke / [HO-]= 10-14 / 2 10-3 = ½ 10-11. pH = - log [H3O+] = 11+log2 = 11,3.
|
||||||||||||||||||||
|
Le vert de malachite est un indicateur coloré dont le pka du couple cpnstitué par la forme acide et la forme basique notées A et B vaut 1,3. La couleur donnée par la forme acide A est jaune et celle donnée par la forme basique est bleu vert.
corrigé à pH > pKa la forme basique prédomine. à pH>pKa+ 1, la forme basique est au moins 10 fois plus importante que le forme acide : donc la couleur de la solution est bleu vert. pH = pKa + log ( B/A) ; log (B/A) = pH-pKa = 2,8-1,3 = 1,5 B/A = 101,5 = 103/2 = racine carrée(1000)= racine carrée 100 * racine carrée 10 = 10*3,1 = 31. |
||||||||||||||||||||
|
|