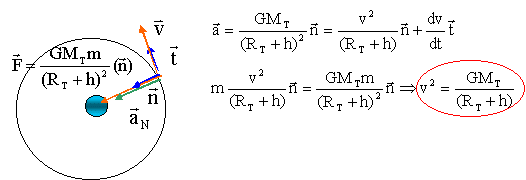|
d'après concours manipulateur radio St Germain 05 .( sans calculatrice) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||
| .
. |
|||||||||||||||||||
|
|||||||||||||||||||
|
|
Un satellite artificiel de masse m= 2,5 tonnes gravite
autour de la terre à une altitude constante h= 270 km. La terre est
considérée comme ayant une répartition de masse à symétrie sphérique.
corrigé Le satellite est en orbite circulaire dans le référentiel géocentrique : origine du repère, le centre de la terre ; les 3 axes pointent vers des étoiles lointaines qui semblent fixes. Le satellite est soumis à la force de gravitation attractive exercée par la terre : force centripète de valeur F= GMTm/(RT+h)². écrire la seconde loi de Newton suivant l'axe n :
RT+h = (6400 + 270) 103 = 6670 103 = 6,67 106 m v²= 6,67 10-11* 6 1024 / (6,67 106)= 6 107 = 60 106 soit v = 7,7 103 m/s = 7,7 km/s. Le satellite décrit une circonférence de rayon RT+h à la vitesse de valeur constante v, durant une période T 2p(RT+h)= vT élever au carré : 4p²(RT+h)²= v²T² remplacer v² par son expression : 4p²(RT+h)²=GMT/((RT+h) T² soit T² / (RT+h)3=4p²/GMT 3ème loi de kepler.
|
||||||||||||||||||
|
A haute altitude l'azote 147N bombardée par les neutrons se transforme en carbone 14 146C. Celui-ci est radioactif b- et possède une demi vie t½= 5600 ans. Données : ln2/5600 = 1,24 10-4 ; 5600/ln2 = 8080.
corrigé 147N +10n= 146C + 11H Dans une réaction de fission, de gros noyaux instables se cassent et conduisent à deux noyaux plus légers et plus stables. Dans une réaction de fusion, de petits noyaux instables fusionnent et conduisent à un noyau plus lourd et plus stable.. il ne s'agit, dans ce cas, ni d'une fusion, ni d'une fission.. 146C = AZX + 0-1e conservation de la charge : 6=Z-1 soit Z= 7 , donc X est l'élément azote N conservation du nombre de nucléons : 14 = A+0 soit A= 14. L'activité, notée A, exprimée en becquerel (Bq) est le nombre de désintégrations par seconde. A= 2 Bq ; A0 = 16 Bq = 8*A = 23A l'activité a été divisée par 8 à t½ l'activité est divisée par 2 ; à 2t½ l'activité est divisée par 4 ; à 3 t½, l'activité est divisée par 8. âge de l'échantillon ancien : 3t½= 3*5600 = 16 800 ans. constante radioactive l caractéristique du carbone 14 : lt½= ln2 l = ln2 / t½= ln2 / 5600 = 1,24 10-4 an-1.
|
|||||||||||||||||||
|
La caféine est reconnue pour ces propriétés stimulantes du système nerveux. Présente dans le café, le thé, elle constitue la forme basique du couple acide base noté BH+/B. A 25°, sous 1 bar, on mesure la conductivité de 500 mL de solution contenant initialement 1,0 10-2 mol de cafèine ; on trouve s = 400 mS cm-1. Données : lHO-= 20 mS m² mol-1 ; lBH+négligeable ; Ke = 10-14 ; log 2 = 0,30.
corrigé B+H2O= BH+ + HO-.
conductivité finale de la solution s = 400 mS cm-1= 4 10-4 S cm-1 =4 10-2 Sm-1. de plus :s =lHO-[HO-]f= 20 10-3 *2000xf =40 xf . 40 xf = 4 10-2 soit xf= 10-3 mol. [B]f=(0,01-xf)/ V= (0,01-0,001)/0,5 =0,009/0,5 = 0,018 mol/L. pH final de la solution : [H3O+]f= Ke/[HO-]f avec [HO-]f = xf /V= 10-3 /0,5 = 2 10-3 mol /L [H3O+]f= 10-14/2 10-3 =½ 10-11 mol/L pH= - log(½ 10-11)= log 2 + 11 = 11,3.
|
|||||||||||||||||||
|
Une unité de fabrication du dihydrogène par électrolyse de l'eau fabrique 450 m3 à l'heure de ce gaz ( volume rapporté aux conditions normales de température et de pression). L'électrolyte utilisé est une solution d 'hydroxyde de potassium K+(aq) + HO-(aq). A l'électrode où se produit le dihydrogène, l'équation de la réaction peut s'écrire : 2H2O(l) + 2e- = H2(g) + 2HO-(aq).
Vm= 22,0 L/mol ; 1 F= 96500 C ; 96500/3600 = 27. corrigé 2H2O(l) + 2e- = H2(g) + 2HO-(aq) réduction de l'eau une réduction se produit à la cathode. quantité de matière (mol) de dihydrogène produite par heure : volume (L) / volume molaire (L/mol) 450 103 / 22 =2,05 104 mol. en conséquence n e= 2 n(H2)= 2* 2,05 104 = 4,1 104 mol d'électrons. Quantité d'électricité : Q= 96 500 ne = It avec I (A) et t(s) I= 96 500 ne / t = 96500* 4,1 104 / 3600 =27*4,1 104=1,1 106 A. l'électrolyse est une transformation
forcée : le système chimique est hors équilibre ( le quotient de
réaction est supérieur à la constante d'équilibre).
|
|||||||||||||||||||
|
|
|||||||||||||||||||
| |
|||||||||||||||||||
|
|