|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||
| .
. |
||
|
||
|
|
En 1986, lors de la catastrophe de Tchernobyl, l'explosion d'un réacteur nucléaire a provoqué la libération dans l'atmosphère de nombreux éléments radioactifs, parmi lesquels le césium 137 et l'iode 131.
Données : césium (Cs, Z=55); Xénon (Xe, Z= 54) ; Baryum (Ba , Z=56) ; Iode ( I, Z=53) corrigé 13153 I = AZ X* + 0-1e conservation de la charge : 53= Z-1 soit Z= 54 et X est le Xénon conservation du nombre de nucléons : 131 = A +0 soit A= 131. 13154 Xe* = 13154 Xe + 00g. le noyau fils peut se trouver dans un état excité ; il libère de l'énergie sous forme de photon g en revenant à l'état fondamental , de moindre énergie, état le plus stable. demi-vie d'un élément radioactif : durée au bout de laquelle la moitié des noyaux radioactifs initiaux se sont désintégrés. l t½=ln2 soit l = ln2 / t½= ln2 / (8*24*3600)= 10-6 s-1. activité initiale : A0= l N0= 10-6* 4,7 1025 =4,7 1019 Bq.
|
|
|
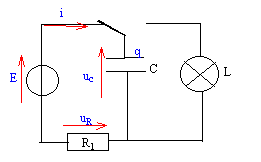
Le flash d'un appareil photo jetable comporte : - Un conducteur ohmique de résistance R1 = 220 W. - Un condensateur de capacitéé C= 3,3 mF - Une lampe de résistance R2= 0,12 W. 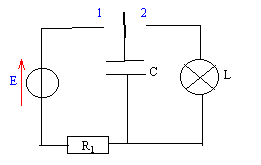
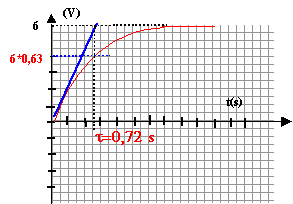
au bout d'une durée supérieure à 5t1= 3,6 s le condensateur est chargé.
E= uc+uR = uc+R1i avec i= dq/dt et q= Cuc soit i= C duc/dt = Cuc'. E= uc+ R1Cuc'. uc(t) = a(1- exp(-bt)) ; uc'= +ab exp(-bt). repport dans l'équation différentielle : E= a [(1-exp(-bt)) +R1C b exp(-bt)] en conséquence, cette égalité est vrai quelque soit t si : b =1/R1C = 1/ t1 et si a= E.
énergie emmagasinnée dans le condensateur : ½C E²= 0,5*3,3 10-3*6²= 5,94 10-2 J. constante de temps t2 = R1C= 0,12*3,3 10-3 = 3,96 10-4 s. puissance (W) moyenne développée par le flash = énergie (J) / durée (s) durée : le condensateur est déchargé au bout de 5 t2 soit 1,98 10-3 s. 5,94 10-2 / 1,98 10-3 = 30 W.
|
||
|
L'acide acéthylsalicylique est plus connu sous le nom d'aspirine. Cet acide noté AH, réagit de façon limitée avec l'eau. On prépare 100 mL de solution S en dissolvant dans l'eau 50 mg d'aspirine. Le pH de la solution obtenue est 3,1.
corrigé concentration molaire initiale en aspirine dans la solution S = Qté de matière (mol) / volume de la solution (L) Qté de matière (mol) = masse (g) / masse molaire (g/mol) =0,05 / 180 =2,78 10-4 mol c=2,78 10-4 / 0,1 =2,78 10-3 mol/L. équation de la réaction de l'aspirine avec l'eau :AH+ H2O= A-+H3O+. pKa = - log Ka = - log(3,2 10-4)= 3,5. si pH est inférieur à 3,5 alors la forme acide AH prédomine si pH est supérieur à 3,5 , c'est la forme base conjuguée A- qui prédomine si pH= pKa=3,5 alors [AH]=[A-] Dans la solution S ( pH<3,5) la forme acide AH prédomine. AH + HO- = A- + H2O. à l'équivalence les quantités de matière des réactifs sont en proportions stoéchiométriques CaVa = CbVéqui soit : Ca= CbVéqui / Va = 2 10-3 *14 / 10 = 2,8 10-3 mol/L résultat en accord avec le calcul ci-dessus ( écart relatif
inférieur à 1%)
|
||
|
Cet accumulateur met en jeu la transformation représentée par : 2 NiO(OH) (s) + Cd(s) + 2H2O (l) = Cd(OH)2 (s) + 2 Ni(OH)2 (s). Le sens direct correspond à la décharge de l'accumulateur.n Au cours de cette décharge, l'équation de la réaction chimique s'écrit : Cd(s) = Cd2+ + 2e-.
corrigé Cd(s) = Cd2+ + 2e- : oxydation du métal cadmium avec libération d'électrons le cadmium constitue la borne négative de l'accumulateur. Qté de matière de cadmium (mol) = masse (g) / masse molaire (g/mol) = 35 / 112,4 =0,311 mol en conséquence la quantité de matière d'électrons est : 2*0,311 =0,622 mol Qté d'électricité : 0,622*96500 = 60097 C. durée (s) = Qté électricité (C) /
intensité (A)=60097/0,75=80129 s.
|
||
|
|