|
d'après bac Afrique 2005. En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||
|
|||
|
|
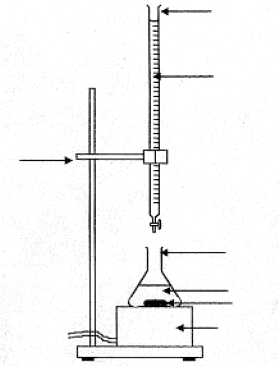
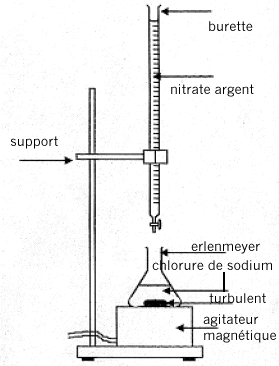
L'argentimétrie groupe un certain nombre de dosages faisant intervenir le nitrate d'argent AgNO3 ( totalement dissocié Ag+ + NO3-). On utilise dans un premier temps la méthode de Mohr pour étalonner la solution de nitrate d'argent à l'aide d'une solution de chlorure de sodium de concentration connue. Puis on utilise la méthode de Charpentier-Volhard pour doser une solution d'acide chlorhydrique. I. Méthode de Mohr :
II Méthode de Charpentier-Volhard : A une prise d'essai de la solution d'acide chlorhydrique à titrer, contenant n0(Cl-) mol d'ion chlorure, on ajoute un excès connu n0(Ag+) mol d'ion argent issus de la solution de nitrate d'argent de concentration c0= 5,00 10-2 mol/L.
équation de cette réaction de précipitation : 2Ag+(aq) + CrO42- (aq) = Ag2CrO4 (solide) La réaction de dosage ne doit pas être concurrencée par une autre réaction ( celle de précipitation de AgOH). D'autre part l'indicateur coloré doit conduire à un changement de couleur ( précipitation chromate d'argent) à une goutte près pour être efficasse. en conséquence le domaine d'utilisation de la méthode de Mohr est 6,5<pH <7,5. la méthode de Mohr correspond à un dosage direct, en une seule étape.
à l'équivalence les quantité de matière des réactifs mis en présence sont en proportions stoechiomètriques : C1V1 = C2 Veq1 ; C2=C1V1
/Veq1= 0,04*20 / 18,2 = 4,4 10-2
mol/L.
deuxième réaction consommant des ions argent : Ag+(aq) + SCN-(aq) = AgSCN(solide) Qtéde matière
initiale d'ion argent : n0(Ag+) Qté de matière d'ion argent consommé par la réaction (2) :néq(SCN-) d'où n0(Ag+)=n0(Cl-)+néq(SCN-) La réaction de dosage ne doit pas être concurrencée par une autre réaction ( celle de précipitation de AgOH). D'autre part l'indicateur coloré doit conduire à un changement de couleur (formation de l'ion complexe non concurrencée par la précipitation de l'ion fer III) à une goutte près pour être efficasse. en conséquence le domaine d'utilisation de la méthode de Mohr est pH <2. la méthode de Mohr ne convient pas pour doser les ions chlorure de cette solution d'acide chlorhydrique : la méthode de Mohr doit se dérouler pour un pH compris entre 6,5 et 7,5. La solution d'acide chlorhydrique a un pH inférieur à 6,5. la méthode de Charpentier-Volhard correspond à un dosage indirect, se déroulant en deux étapes. On dose dans la seconde étape l'excès d'ion argent qui n'a pas réagi avec les ions chlorure ( étape 1) n0(Ag+)=n0(Cl-)+néq(SCN-) n0(Ag+)=C0V0 ; n0(Cl-)=VACA ; néq(SCN-) = Véq2C2 ; C0V0= VACA +Véq2C2 ; CA =(C0V0-Véq2C2)/VA=(0,05*25-8*0,04)/ 10 = (1,25-0,32)/10 = 9,3 10-2 mol/L.
|
||
|
|