|
mécanique -datation au carbone 14- l'aspirine En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
|
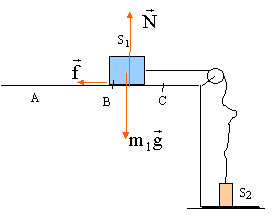
On entraîne un solide S1 de masse m1 par la chute d'un solide S2 de masse m2 sur une hauteur H. Ainsi lancé sur la longueur H, le solide S1 frottant sur le support horizontal parcourt la distance d avant de s'arrèter. Le fil de liaison est supposé inextensible et de masse négligeable. On néglie la masse de la poulie de transmission. On note f la valeur de la force de frottement qui est constante tout le long du parcourt AC. La vitesse initiale en A est nulle. 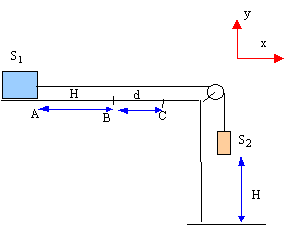 étude dynamique sur le parcourt AB :
étude dynamique sur le parcourt AB :
m1 = 1,4 kg ; m2 = 850 g ; g= 9,8 m/s². corrigé 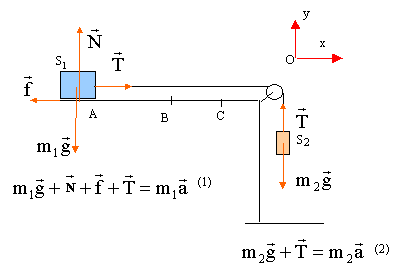
(1) s'écrit sur l'axe Ox : -f + T=m1a (2) s'écrit sur l'axe Ox : -m2g + T=- m2a éliminer la tension T : -m2g +m1a +f = -m2a a = (m2g -f) / (m1+m2). f = m2g- a (m1+m2) = 0,85*9,8- 3*(1,4+0,85) =8,33 -6,75 = 1,6 N. le mouvement de S1 est rectiligne uniformément accéléré, sans vitesse initiale Les origines des espaces et des dates sont prises au départ en A. v(t) = a t ; x(t) = ½at² ; v²B = 2aH vB= 3*0,5 = 1,5 m/s ; H= v²B
/( 2a) = 1,5²/6= 0,375 m.
sur le parcours BC seule la force de frottement travaille ( poids et action normale du support sont perpendiculaires à la vitesse) W(f) = f d cos (180 ) = -fd variation de l'énergie cinétique entre B et C : DEc= 0-½m1v²B. théorème de l'énergie cinétique : -fd = -½m1v²B. d= ½m1v²B / f = 0,5*1,4*1,5²/ 7 = 0,225 m.
|
|||||||||||||||||||||||||||||||||||||||
|
"Le carbone 14 est produit dans la haute atmosphère où les protons du rayonnement cosmique percutent les molécules qui composent l'air. Les réactions nucléaires qui résultent de ces chocs produisent des neutrons secondaires. Ces neutrons ont une forte probabilité de réagir avec l'azote de l'air ( 14N) pour donner un proton et un isotope du carbone : le carbone 14. dans le milieu naturel la production du carbone 14 et sa disparition par désintégration radioactive s'équilibrent. On estime qu'il y a environ 10-12 fois moins d'atomes de carbone 14 que d'atomes de carbone stable (12 C). Il en résulte une radioactivité faible du carbone.... Lors de la mort de l'organisme cet équilibre est rompu. Les atomes de carbone 14 disparaissent peu à peu." Données : numéro atomique C : Z=6 ; N: Z=7. La demi vie du carbone 14 est T=5730 ans ; lors de la désintégration du carbone 14 on détecte des particules b-. masse atomique molaire C=12 g/mol NA= 6,02 1023 mol-1. A partir du texte répondre aux questions :
corrigé carbone 12 : 6 protons et 6 neutrons ; carbone 14 : 6 protons et 8 neutrons ; azote 14 : 7 protons et 7 neutrons 147N + 10n --> 146C + 11p 146C -->AZX + 0-1e ( électron) activité A: nombre de désintégrations par seconde ; elle s'exprime en becquerel (Bq) A= l N dans 1 g de carbone il y a : 1/12*6,02 1023 = 5 1022 atomes de carbone soit environ N= 5 1022 * 10-12 = 5 1010 atomes de carbone 14. l T½=ln2 avec T½ = 5730 ans = 5730*365*24*3600 = 1,8 1011 s l = ln2 / 1,8 1011 = 3,85 10-12 s-1. activité A = 3,85 10-12 * 5 1010 = 0,2 Bq. loi de décroissance radioactive : NCh = N0 e -lt ou ln(N0 /NCh)= lt dans 2 g de charbon Nch= 2,1 109 atomes donc dans 1 g : Nch= 1,05 109 atomes 14C. N0 = 5 1010 atomes de carbone 14 dans 1 g ; l = ln2 / 5730 = 1,21 10-4 an-1. ln(N0 /NCh)= ln(5/0,105 )= 3,86 t = 3,86 / 1,21 10-4 = 3,2 104 ans.
|
||||||||||||||||||||||||||||||||||||||||
|
On prépare V1= 10 mL d'une solution aqueuse S1 d'acide éthanoïque de concentration C1 = 0,2 mol/L. On ajoute rapidement à cette solution V2 = 15 mL d'une solution aqueuse S2 d'hydrogénocarbonate de sodium ( Na+ + HCO3-) de concentration c2 = 0,1 mol/L. On suppose que les réactions de l'acide éthanoïque et de l'ion hydrogénocarbonate avec l'eau est négligeable. l'acide éthanoïque appartient au couple CH3COOH / CH3COO- de pka1 = 4,8 ; l'ion hydrogénocarbonate est la base conjuguée du couple acide base H2O, CO2 dissous / HCO3- de pKa2 = 6,4
avec Ka1 = [CH3COO- ]éq[H3O+] / [CH3COOH ]éq et Ka2 = [HCO3- ]éq[H3O+] / [ CO2 dissous]éq K= Ka1 /Ka2 = 10-4,8 / 10-6,2 = 101,4= 25,1. quotient de réaction initial Qr i= [CH3COO- ]i[ CO2 dissous]i / ( [CH3COOH ]i[HCO3-]i ) =0 Qr i < K donc évolution
spontanée dans le sens directe ( gauche à droite).
= 2 10-3 mol =1,5 10-3 mol 1,5 10-3 mol 25,1(2 10-3 -xéq)(1,5 10-3 -xéq) = x2éq . 24,1 x2éq - 8,785 10-2 xéq+ 7,53 10-5 = 0 D= (8,785 10-2)²-4*24,1*7,53 10-5 =4,58 10-4 ; racine carrée ( )= 0,0214. xéq = ( 0,0878 -0,0214) / (2*24,1) = 1,38 10-3 mol. taux d'avancement final t = xéq / xmax =
1,38 /1,5 = 0,92 réaction partielle.
[CH3COO- ]éq = [ CO2 dissous]éq = 1,38 10-3 / 25 10-3 = 0,0552 mol/L [CH3COOH ]éq= 0,62 10-3 / 25 10-3 = 0,0248 mol/L [HCO3-]éq =0,12 10-3 / 25 10-3 = 0,0048 mol/L [ CO2 dissous]éq supérieure à la solubilité du dioxyde de carbone ; donc une partie du gaz se dégage une partie du CO2 se dégage : tout ce passe comme si l'un des produits était partiellement éliminé et l'équilibre est donc déplacé vers la droite, dans le sens direct.
|
||||||||||||||||||||||||||||||||||||||||
|
|