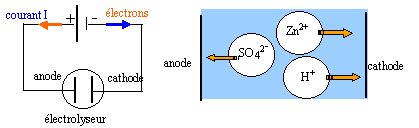|
Kiné
efom d'après concours 2004 sans calculatrice
rotation d'une bille -dipôle
(LC) - le radium - électrolyse -acide
perchlorique
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
Une bille assimilable à un point matériel B de masse m est
reliée par deux fils inextensibles de masse négligeable à deux points A
et C d'un axe vertical D. On note AB=BC=L
et AC= d
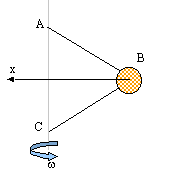
- On considère le repère orthonrmé (B, x, y) avec Bx
horizontal orienté vers la gauche et By vertical orienté vers le haut.
On pose a l'angle que fait chaque fil BA et
BC avec l'axe Bx. Donner les expressions de sin a
et cos a en fonction de L et d.
- La bille tourne à vitesse angulaire w constante
autour de l'axe D. Les fils restent
constamment tendus.
- Faire un schéma et représenter les forces exercées sur la bille B
- Donner les expressions littérales des tensions T1 et T des
deux fils en fonction de w, m, g, d et L
- Montrer que le fil BC n'est tendu qu'à partir d'une
certaine valeur w 0 de la
vitesse angulaire dont on donnera l'expression en fonction des données
du problème.
corrigé
sin a = ½d /
L et cos a = BH / L avec BH²=L²-0,25 d²
cos a = (L²-0,25 d²)½/ L
suivant l'axe By vertical, l'accélération est nulle : T sin a -T1sin a
-mg=0
T -T1= mg /sin a =2 mgL
/ d (1)
suivant l'axe Bx : Tcos a +T1cos
a =mw²BH = mw²Lcosa
T+T1= mw²L (2)
(1) +(2)
donne 2T= 2 mgL / d +mw²L
T= mgL/d + ½mw²L = mL(g/d+½w²).
repport dans (1) T1=
T-2mgL= mgL/d + ½mw²L -2mgL/d
T1= ½mw²L -mgL/d = mL(½w²- g/d).
le fil de dessous est tendu à condition que la vitesse
angulaire soit supérieure à : w²0
>= 2g/d.
|
|
- La tension aux bornes d'un condensateur AB de capacité
C=0,1 mF est U0=10 V. Déterminer
la charge q0 stockée dans ce condensateur.
- A la date t0 ce condensateur est branché aux
bornes d'une bobine de résistance négligeable et d'inductance L= 1 H.
L'intensité du courant est nulle à cet instant.
- Faire le schéma du montage et établir l'équation différentielle à
laquelle satisfait la charge q(t) du condensateur.
- Calculer la pulsation propre w0
ainsi que la période propre T0.
- En utilisant
les conditions initiales donner l'expression de la charge q(t) du
condensateur en fonction de t, w0
C et U0 ainsi que l'expression de l'intensité i(t) en
fonction de t, w0 C et U0.
- En déduire l'expression de la tension UAB(t) aux bornes du
condensateur en fonction de t, w0
et U0
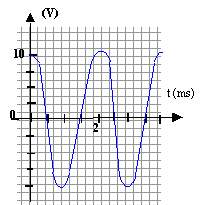
- On visualise UAB(t) sur l'écran d'un
oscilloscope ( 0,5 ms/div et 5 V/div). Représenter la courbe observée
sur l'écran de 8 cm de large.
- Donner l'état du condensateur (charge, tension aux bornes,
énergie stockée) ainsi que l'intensité du courant et l'énergie WL
de la bobine aux dates t=0 ; t1=0,25 T0 ; t2=0,5
T0 ; t3=0,75 T0 .
Données : racine carrée 10-7 = 3,2 10-4 ; racine
carrée(107 )= 3200 ; 2p racine
carrée 107 = 2 10-3 ;
corrigé
charge q0 = CU0 = 10-7*10 = 10-6 C.
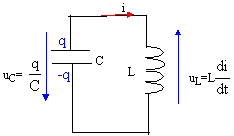
q/C + Ldi/dt = 0
avec i= dq/dt soit di/dt = d²q/dt² = q"
q/C+Lq"=0 ou bien
q" + 1/(LC)q=0
on pose w²0= 1/(LC) d'où T0= 2p/ w0 = 2p (LC)½ .
w0 = 1/(LC)½
=1/(1*10-7)½= 3200 rad/s.
période T0=
2*3,14 / 3200 = 2
10-3s.
les solutions de
l'équation différentielle sont de la forme q(t) = QM cos(w0 t+j)
à l'instant
initial, le condensateur est chargé : QM= CU0.
QM= QMcos(j) donne j =0
q(t) = CU0
cos(w0 t).
dériver par
rapport au temps pour obtenir l'intensité
i = CU0
(-w0 ) sin(w0 t)
tension aux
bornes du condensateur : u(t)= q(t) / C = U0 cos(w0
t).
8 cm de large
correspondent à 8*0,5 = 4 ms soit deux périodes.
|
temps (ms)
|
0
|
0,5
|
1
|
1,5
|
|
charge (C)
|
10-6
|
0
|
-10-6
|
0
|
|
tension aux bornes du condensateur(V)
|
10
|
0
|
-10
|
0
|
|
énergie stockée ( condensateur) ½CU²
|
5 mJ
|
0
|
5 mJ
|
0
|
|
intensité (mA)
|
0
|
CU0
(-w0 ) = -3,2
|
0
|
3,2
|
|
énergie stockée dans la bobine ½Li²
|
0
|
5 mJ
|
0
|
5 mJ
|
|
|
Le radium 22688Ra
se désintègre spontanément en émettant une particule a. Le noyau fils est un isotope du radon (Rn),
gaz dans les conditions ordinaires de température et de pression.
L'isotope 22688Ra est radioactif b-.
- Préciser en le
justifiant si la masse d'un noyau de radium est égale à la somme des
masses de ses nucléons.
- Ecrire
l'équation de désintégration du radium 22688Ra.
- Préciser en le
justifiant si le radium 22688Ra et le radon 22686Rn
sont isotopes.
- Donner le nom
du noyau fils résultant de la désintégration du radium 22688Ra.
- La demi vie du
radon 22286Rn est de 3,8 jours. Donner le
pourcentage de noyaux de radon 22286Rn restants
par rapport au nombre initial au bout de 11,4 jours.
- Le noyau de
radium 22688Ra est obtenu à partir d'une suite
de désintégrations radioactives a et
b- du noyau d'uranium
23892U. Déterminer le nombre de
particules a et le nombre d'électrons émis
au cours de ces désintégrations successives.
- Un échantillon
de "radium 226" a un activité de 6 105 Bq. Déterminer le
nombre de noyaux de radium 22688Ra désintégrés
en une minute.
- Déterminer
l'énergie libérée ( en MeV) au cours de de la réaction de
désintégration du radium 22688Ra.
- La teneur en
radon 22286Rn dans les gaz du sol a été
déterminée en mesurant une activité de 3,75 103 Bq par m3
de gaz prélevé. La constante radioactive l du
radon est 2,1 10-6 s-1. déterminer la quantité de
matière (mol) en 22286Rn dans 1 m3
responsable de cette activité.
NA=
6,02 1023 mol-1.masse noyau helium : 4,003 u ;
masse du noyau de radium 226 : 226,05 u ; masse du noyau de radon 222 :
222,042 u; énergie de masse correspondante à 1u : 930 MeV
Radon (Z=86) ;
Francium (Z=87) ; Radium (Z=88) : Actinium (Z=89) ; Thorium (Z=90) ;
Proactinium (Z=91) ; Uranium (Z=92)
aide aux calculs
: 3,75 / 2,1 = 1,79 ; 1,79 / 6,02 = 0,3.
corrigé
la masse d'un noyau de radium est inférieure à
la somme des masses de ses nucléons : la perte de masse correspond à
l'énergie de cohésion du noyau
22688Ra-->22286Rn
+ 42He ( noyau fil "radon 222" )
deux isotopes ne
diffèrent que par leur nombre de neutrons ( donc même numéro atomique )
: le radium 22688Ra et le radon 22686Rn
ne sont donc pas isotopes.
11,4 jours
correspond à 3 fois la demi vie : donc le nombre de noyaux initiaux est
divisé par 23 = 8 ; il ne reste donc que 12,5 % de noyaux
radioactifs.
à chaque désintégration b- le numéro atomique augnente de 1
unité alors que le nombre de masse A ne change pas.
à chaque
désintégration a le numéro atomique diminue de
2 unités et le nombre de masse diminue de 4 unités
or le nombre de
masse diminue de 238-226 = 12 unités : donc 3 désintégrations de type a.
en conséquence le
numéro atomique diminue de 6 unités ;
or au total on
observe une diminution de 92-88 = 4 unités
donc 2
désintégrations de type b-.
l'activité est le nombre de désintégrations par
seconde soit 6 105.
en 1 min = 60
secondes : 60*6 105 = 3,6 107 noyaux se
désintègrent.
|Dm|= |4,003 + 222,042-226,05| =5
10-3 u
énergie libérée :
5 10-3*930 = 4,65 MeV.
A=l N soit N= A /l = 3,75 103 / 2,1 10-6 =
3,75/2,1 109 = 1,79 109 noyaux
dans une mole il
y a 6,02 1023 noyaux
Quantité de
matière (mol) = 1,79 109 / 6,02 1023 = 1,79 /2,1
10-14 = 0,3 10-14 mol.
|
|
Certains métaux sont préparés par électrolyse d'une solution
aqueuse les contenant à l'état de cations. Le zinc est obtenu par
électrolyse d'une solution de sulfate de zinc acidifiée par l'acide
sulfurique. Les ions sulfates ne participent pas aux réactions
électrochimiques. On observe un dépôt métallique sur l'une des
électrodes et un dégagement gazeux sur l'autre.
A- étude théorique :
- Quelles sont les réactions susceptibles de se produire sur
chaque électrode sachant que c'est le solvant qui est oxydé en
dioxygène. Couples redox : Zn2+ / Zn (s) ; H+/ H2(g)
; O2(g) / H2O.
- Schématiser l'électrolyseur, en précisant le nom de chaque
électrode et le sens de déplacement des espèces chargées.
- En justifiant le choix des couples, vérifier que l'équation
globale de cette électrolyse est :
Zn2+ + H2O =Zn (s) + ½ O2(g) + 2H+.
- S'agit-il d'une transformation spontanée ou forcée ?
Pourquoi ? Quelle vérification théorique proposeriez-vous ?
- Etablir le tableau d'avancement correspondant à la réaction
d'électrolyse.
B- Etude quantative :
L'électrolyse a lieu sous 3,5 V. L'intensité du courant peut
atteindre 80 kA. Après 48 heures de fonctionnement, le dépôt de zinc
est suffisamment épais.
- Quelle est la relation entre l'avancement x et la quantité
d'électricité Q transportée dans cet électrolyseur ?
- Quel est l'ordre de grandeur de la masse de zinc produite
par une cellule en 2 jours ?
- En fait on obtient une quantité de zinc inférieure à celle
attendue. Pourquoi ?
- A l'autre électrode on récupère le dioxygène. Le rendement
de la réaction qui le produit est de 80 % et le volume molaire de 24
L/mol. Donner la relation entre l'avancement x et le volume V de
dioxygène récupéré. Quel est l'ordre de grandeur de V ?
masse molaire du zinc :65 g/mol ; masse volumique du zinc r =7 g/cm3 ; 1 faraday = 105
C
calculs : 65*8*48*36=9 105 ; 8*48*36=14 000 ; 65*48
/(8*36)=10 ; 8*48/36 =10
corrigé
à la cathode négative se produit une réduction
Zn2+ +
2e- = Zn (s)
2H+ +
2e- = H2(g)
à l'anode
positive se produit une oxydation
H2O =
½O2 + 2H++ 2e-
bilan de
l'électrolyse : Zn2+ +H2O = ½O2 +2H++
Zn (s)
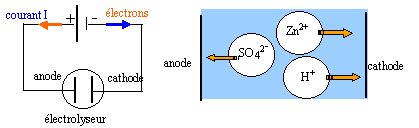
l'électrolyse est
une transformation forcée nécesitant un apport d'énergie électrique. La
réaction spontanée est l'attaque ( oxydation ) du zinc métal par un
acide. Le zinc est plus réducteur que l'eau.
|
Zn2+
|
+H2O
|
= ½O2
|
+2H+
|
+ Zn
(s)
|
|
t=0
|
C V
|
solvant
|
0
|
excès
|
0
|
|
en cours
|
CV-x
|
0,5 x
|
x
|
|
fin
|
CV-xmax=0
|
0,5 xmax=
|
xmax=CV
|
C= concentration (mol/L) en ion zinc et V volume de la solution en
litre.
Zn2+ + 2e- = Zn (s)
la quantité de
matière d'électrons est égale à 2 fois la quantité de matière de zinc
soit 2x
la charge d'une
mole d'électrons vaut , en valeur absolue 96 500 C environ 105
C
Q=2 x 105
coulombs
d'autre part Q=
I(A) t( s) = 8 104 * 48*3600 =8*48*36 106 = 14 109
C
d'où x =14 109
/(2 105) = 7 104 mol
masse de zinc
:(g) = masse molaire (g/mol) * Qté de matière (mol) = 65*7 104
= 4,55 106 g = 4,55 tonnes.
à la cathode une
réduction concurente se produit : 2H+ + 2e- = H2(g)
la masse réelle
de zinc sera donc plus faible.
à l'anode H2O = ½O2 + 2H++
2e-
la quantité de
matière de dioxygène est 4 fois plus faible que la quantité de matière
d'électrons :0,25 * 7 104 mol
volume de
dioxygène : 24*0,25*7 104 = 4,2 105 L = 420 m3
en tenant compte
du rendement 420*0,8 = 336 m3.
|
|
L'acide perchlorique a pour formule HClO4. Sa
transformation avec l'eau est totale (acide fort). L'acide lactique a
pour formule CH3-CHOH-COOH. Sa transformation sur l'eau est
limitée.
Les étiquettes de deux flacons contenant de l'acide lactique
et de l'acide perchlorique ont été abimées. On cherche à attribuer un
nom correct à chaque solution en procédant à deux expériences.
Expérience 1 : on réalise un titrage colorimétrique
d'un volume vA= 10 mL de chacune des solutions acide par une
solution d'hydroxyde de sodium( Na+ ; HO-) de
concentration en soluté apporté Cb= 0,1 mol/L. On détermine
le volume de soude versé à l'équivalence pour chaque solution :
solution A: VBE=10 mL ; solution A' :V'BE= 16 mL
Expérience 2 : on mesure le pH de chaque solution.
Solution A : pH=1 ; solution A' : pH=2,3.
- Ecrire les formules de l'ion perchlorate, base conjuguée de
l'acide perchlorique et de l'ion lactate, base conjuguée de l'acide
lactique.
- Ecrire les réaction de l'action de l'acide perchlorique et de l'acide
lactique sur l'eau.
- Etude de la première expérience :
- Ecrire l'équation de la réaction, de titrage de l'acide lactique par
les ions hydroxydes HO-.
- Ecrire l'équation de la réaction, de titrage de l'acide perchlorique
par les ions hydroxydes HO-.
- Définir l'équivalence d'un titrage.
- Dresser le tableau d'avancement de chacune des deux réactions de
titrage. Déduire des résultats de l'expérience les concentrations
molaires de chaque solution .
- Etude de la seconde expérience :
- Dresser le tableau d'évolution descriptif du système dans le cas de
la réaction d'un acide HA avec l'eau. La concentration de soluté
apporté est C et le volume est V.
- En déduire l'expression de l'avancement maximal xmax et de
l'avancement à l'équilibre xf dans le cas de la réaction
d'un acide avec l'eau.
- Calculer le taux d'avancement final t
pour chaque solution.
- Conclure en donnant le nom de l'acide contenu dans chaque solution.
aide au calcul : 10-2,3 = 5 10-3.
corrigé
CH3-CHOH-COO- et
ClO4-.
CH3-CHOH-COOH + H2O = CH3-CHOH-COO-
+ H3O+.
HClO4+ H2O = ClO4-
+H3O+.
à l'équivalence les quantités de matière
de réactifs mis en présence sont en proportions stoéchiométriques.
CH3-CHOH-COOH + HO- = CH3-CHOH-COO-
+H2O
HClO4+ HO- = ClO4-
+ H2O
|
AH
|
+ HO- ajouté
|
= A-
|
+ H2O
|
|
initial
|
CVA
|
0
|
0
|
solvant
|
|
en cours
|
CVA -x
|
x= CbVb
|
x
|
|
équivalence
|
CVA -xéq=0
|
xéq=CbVéq
|
xéq
|
CVA =CbVéq soit C =CbVéq
/ VA =0,1Véq /10 = 0,01Véq .
CA= 0,01*10 = 0,1 mol/L ; CA'= 0,01*16 =
0,16 mol/L
|
AH
|
+ H2O
|
= A-
|
+H3O+
|
|
initial
|
CV
|
solvant
|
0
|
0
|
|
en cours
|
CV -x
|
x
|
x
|
|
équilibre
|
CV -xéq
|
xéq = 10-pH V
|
xéq = 10-pH V
|
|
si réaction totale
|
CV -xmax=0
|
xmax=CV
|
xmax=CV
|
t =xéq /xmax=10-pH
/C
solution A : 0,1 / 0,1 =1 réaction totale , acide fort HClO4.
solution A' : 10-2,3 / 0,16 = 5 10-3 /
0,16 =0,031 réaction partielle , acide lactique
|
|
|
|
retour -menu
|