|
- circuit en régime sinusoïdal (8 points) d'après bac Sti génie des matériaux 2004 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||
|
|||
|
|
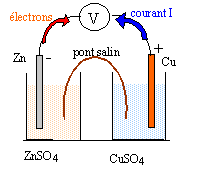
oxydo-réduction : potentiel standart à 298 K des couples oxydant / réducteur E0(Cu2+/Cu)= 0,34 V ; E0(H3O+/H2)= 0,0 V ; E0(Zn2+/Zn)= -0,76 V ;
On verse une masse m= 2,7 g d'aluminium dans un erlenmeyer contenant 600 mL d'une solution d'acide chlorhydrique telle que la concentration en ion oxonium soit 0,1 mol/L. L'équation chimique de la réaction qui se produit est : 6 H3O+ + 2Al(s) = 2 Al3+ + 3H2(g) + 6H2O On donne la masse molaire de l'aluminium 27 g/mol
corrigé Cu2++ 2e- = Cu(s) 2H3O++2e- = H2(g)+ 2H2O Zn2++ 2e- =Zn(s) On plonge une lame de cuivre dans une solution d'acide chlorhydrique :pas de réaction car le cuivre est un réducteur plus faible que H2.( ou bien l'ion Cu2+ est un oxydant plus fort que H3O+) On plonge une lame de zinc dans une solution d'acide chlorhydrique : réaction car le zinc est un réducteur plus fort que H2. Zn (s) + 2H3O+ = Zn2+ + H2(g) + 2H2O le zinc est le réducteur, l'ion H3O+ est l'oxydant.
E= E0(Cu2+/Cu )- E0(Zn2+/Zn
) = 0,34-(-0,76) = 1,1 V
Qté de matière ion oxonium (mol) = volume (L) * concentration (mol/L) = 0,6*0,1 = 0,06 mol 6 H3O+ + 2Al(s) = 2 Al3+ + 3H2(g) + 6H2O D'après l'équation, à partir de 0,1 mol Al il faudrait 0,3 mol ion oxonium or il n'y en a que 0,06 mol: Al en excès et ion oxonium en défaut. à partir de nH3O+= 0,06 mol d'ion oxonium, les coefficients de l'équation indiquent qu'il se forme nH2 = ½ nH3O+=0,03 mol soit en volume : 0,03*24 = 0,72 L H2.
|
||
|
Diagramme de solidification plomb étain 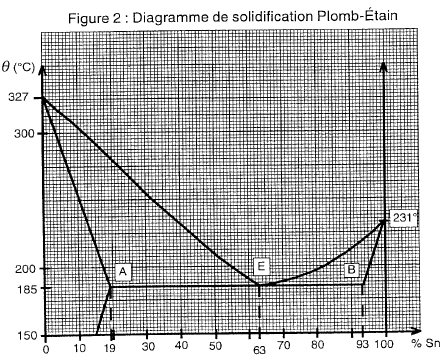
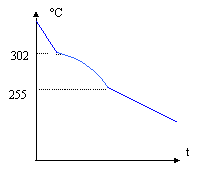
corrigé températures de début qd = 302 °C et de fin de solidification q f = 255°C de l'alliage à 10 % d'étain
état physique de cet alliage à 10 % d'étain si la température est 200°C : solide, alliage homogène, solution solide. l'alliage à 63 % d'étain : eutectique
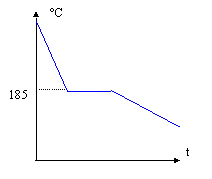
l'eutectique à 184°C est constitué de solution solide d'étain à 19% et de solution solide d'étain à 93%. On calcule les pourcentages de ces deux phases homogènes grâce à la règle des moments. solution solide d'étain à 19% :EB/AB*100 = 30/74 *100 = 40,5% solution solide d'étain à 93% : AE/AB*100 = 44/74*100 = 59,5%.
|
|||
|
circuit en régime sinusoïdal On place en série une résistance R, une bobine supposée parfaite d'inductance L et un condensateur de capacité C. Le dipôle ainsi constitué est alimenté sous une tension sinusoïdale u(t) fournie par un générateur basse fréquence. On appelle uR(t) la tension aux bornes de la résistance, uL(t) la tension aux bornes de la bobine, uC(t) la tensuion aux bornes du condensateur, i(t) l'intensité du courant.
corrigé 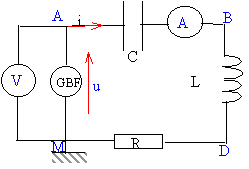
w=2pf soit f = 1418 / 6,28 =225 Hz. valeur maximale de u(t) : Umax = U racine carrée (2) = 24*1,414 = 34 V. u(t) = Umax cos (wt) impédances ZR= R = 50 W ZL = Lw = 0,141*1418 = 200 W ZC = 1/(Cw) = 1/(4,7 10-6 *1418)= 150 W. impédance de l'ensemble Z= U / I = 24/0,34 = 70,6 W. puissance joule Pj= RI² = 50*0,34² = 5,78 W. la puissance absorbée par l'ensemble est égale à la puissance joule. puissance apparente S=UI= 24*0,34 = 8,16 VA. facteur de puissance k= P/S= 5,78 / 8,16 = 0,71. condition de résonance LCw0²=1 w0²= 1/(LC) = 1/(0,141*4,7 10-6) = 1,5 106 prendre la racine carrée w0 = 1,23 103 rad/s f0 = 1,23 103 / (2*3,14) = 195,6 Hz. à la résonance Z= R= 50 W et Z= U/I d'où I= U/Z = 24 /50 = 0,48 A.
|
|||
|
|