|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||||||
|
||||||||||||||||||
|
|
Le cadmium est obtenu par électrolyse d'une solution aqueuse de sulfate de cadmium ( Cd2+ ; SO42-) et d'acide sulfurique ( 2H+ ; SO42-). Les ions sulfate ne réagissent pas.Couples oxydant-réducteur : Cd2+(aq) / Cd(s); H+(aq) / H2(g) ; O2(g) / H2O(l). La tension aux bornes de la cuve à électrolyse vaut U = 3 V et l'intensité ducourant vaut I = 20 kA
corrigé 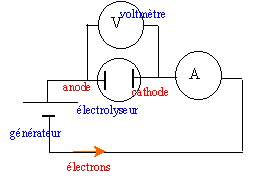
à la cathode négative se produit une réduction des ion Cd2+. Cd2+ + 2e- = Cd (s) à l'anode positive se produit une oxydation de l'eau H2O = ½O2 + 2H++ 2e- bilan de l'électrolyse : Cd2+ +H2O = ½O2 +2H++ Cd (s)
Qté de matière de cadmium formé en t seconde : xfin = It / (2F) xfin =2 104*965 / (2*96500) = 100 mol.
|
|||||||||||||||||
corrigé 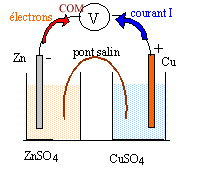
à l'anode négative, le zinc s'oxyde : Zn (s) = Zn2+ + 2e-. à la cathode positive, les ions Cu2+ se réduisent : Cu2+ + 2e- = Cu(s). Dans les plaques métalliques et dans les fils de cuivre, les électrons assurent le passage du courant. Dans les solutions et le pont salin les ions assurent le passage du courant électrique. solution ZnSO4 : migration des ions sulfate SO42- vers la droite. La concentration en ion Zn2+ augmente ; pour assurer l'électroneutralité de la solution, migration des ions Cl- du pont salin vers le bécher de gauche. solution CuSO4 : migration des ions sulfate SO42- vers la droite. La concentration en ion Cu2+ diminue ; pour assurer l'électroneutralité de la solution, migration des ions K+ du pont salin vers le bécher de droite. La transformation du système chimique est spontanée. La pile en fonctionnement est un système hors équilibre.
|
||||||||||||||||||
|
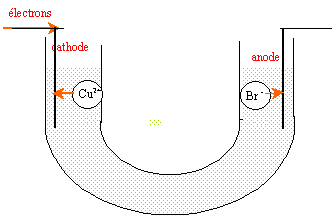
On réalise l'électrolyse d'une solution aqueuse de bromure de cuivre II avec des électrodes inattaquables en graphite. On observe un dépôt rougeâtre à l'une des électrodes. Les seuls couples mis en jeu sont : Cu 2+ (aq) / Cu(s) et Br2 (aq) / Br - (aq). 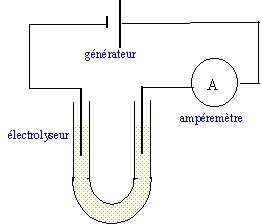
corrigé espèces chimiques initialement présentes en solution : H2O, Cu2+ et Br-.
A l'anode positive, les ions Br- s'oxydent en Br2 rouge brun. 2Br- = Br2 + 2e-. A la cathode négative, les ions Cu2+ se réduisent en Cu(s). Cu2+ + 2e-= Cu(s) équation de la réaction associée à l'électrolyse : Cu2+ +2Br- = Br2 + Cu(s) L'électrolyse est
une transformation forcée, nécessitant un apport d'énergie sous forme
d'énergie électrique.
|
||||||||||||||||||
| |
||||||||||||||||||
|
|