Mathématiques
Exercice M1 ( 5 points)
.
Une étude menée clans la population de Ia ville à la
fin de la période hivernale a permis de constater gue :
. 40 % de la population est vaccinée .
8 % des personnes vaccinées ont contracté la grippe ,
20 % de la population a contracté la grippe.
On choisit une personne au hasard dans la populatior le la vilte et on
considère tes éléments suivants :
V : " la personne est vaccinée contre la grippe "
G : " la personne a contracté Ia grippe "
1- a) Donnez la
probabilité de l'évènement G. Détaillez votre réponse.
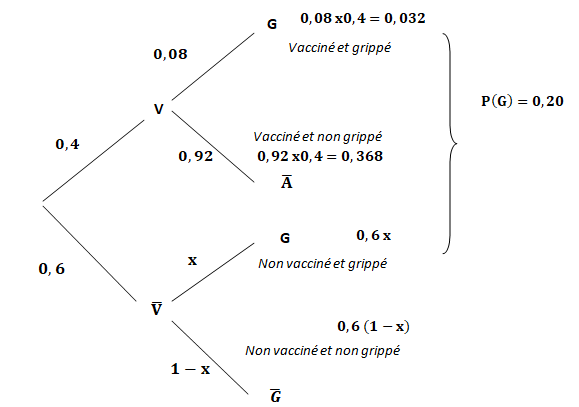
b) Construisez un
arbre pondéré de la situation.
 2-
2- Déterminez la
probabilité que la personne choisie ait contracté la grippe et soit
vaccinée.
P( G n V) = 0,4 x0,08 =0,032
3. La personne
choisie n'est pas vaccinée. Montrez, en détaillant votre réponse, que
la probabilité qu'elle ait
contracté la grippe est égafe à 0,28.
P (G) = 0,20 = 0,032 +0,6x ; x = (0,20-0,032) / 0,6 =0,28.
Exercice M2 (
4 points)
1. Calculez
l'intégrale suivante :
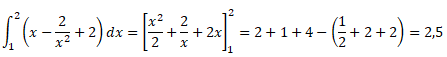 2.
2. Calculez la
limite en plus l'infini de l'expression suivante : 1/x
2+x
2.
1/x
2 tend vers zéro et x
2 tend vers plus l'infini.
3. Soit la fonction
f{x} = 3x
3+2x
2-3x+1 définie sur R , calculez la
fonction dérivée de f(x).
f '(x) = 9x
2 +4x-3.
4. Soit la fonction
g(x) = x(x+1) définie surR calculez ia fsncrion dérivée g'(x) de g(x).
On pose u = x et v = x+1 ; u' =1 ; v' = 1.
u'v+v'u = x+1 +x = 2x+1.
Exercice M3 (5 points)
1- Soit u une
fonction dérivable et stricternent positive sur un intervalle J et u'
sa dérivée.
La dérivée de la fonction f{x)= ln(u(x)) sur J est :
a) f '{x)= u'(x) / u(x) vrai.
b) f '{x)= u(x) / u'(x).
f '{x)= u'(x) * u(x).
2. Soit a un réel strictement
positif et n un entier naturel. ln( a½n) est égal à
(plusieurs solutions possibles} :
a) n+½ln(a) ; b) n ln(a½) vrai
; c) n+ln(a½) ; d) ½n ln(a) vrai.
3. Soit la fonction
g{x) = xex - ex +1. Calculez la dérivée g'{x) de
g(x).
Dérivée de x ex: u = x ; v = ex ; u'=1 ; v' = ex
; u'v+v'u =ex+xex.
g'(x) = ex+xex-ex =xex.
4. soit f une
fonction dérivable en 2, le nornbre dérivé de f en 2 est :
a) f(2) ; b) (f(2+h) -f(2)) / h ; limite quand h tend vers zéro de (f(2+h) -f(2)) / h vrai.
5.
Soit f(x) = 1/(x+2)2 définie sur R-{-2}.
Calculez l'équation de la droite asymptote à la courbe représenrative
de f(x).
En plus l'infini et en moins l'infini, f(x) tend vers zéro : l'axe des
abscisses y =0 est asymptote.
Quand x tend vers -2, f(x) tend vers plus l'infini ; la droite
d'équation x = -2 est asymptote.
Exercice M4
(5 points).
1. Donnez la bonne
réponse. Soit n entier naturel non nul, la limite en plus l'infini de
l'expression suivante est égale à :
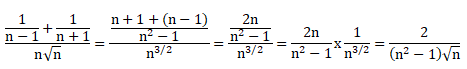
Quand n tend vers plus l'infini, cette expression tend vers zéro.
Réponse
a.
a) 0 Uj +oo e)-* dlon treraitpas
2. L
a limite en plus l'infini de
l'expression suivante est égale à :
(x
2-3x+1) / (x
9+8x-1).
En plus l'infini cette expression est équivalente à x
2 / x
9
= 1 /x
7.
Elle tend donc vers zéro.
Réponse
a.
3. Dans les deux
cas ci-dessous, u
n est une suite géométrique de prernier
terrne u
0 et raison q.
a) §achant que u
0=1
et que q= -4/3, trouvez u
18.
u
18 = u
0 x q
18=(-4/3)
18 =
(4/3)18 .
b) Sachant que u
25
=1 et u
31=729, calculez q (2 solutions possibles).
u25
= u0 x q25=q25 = 1 ; u31
= u0 x q31 = q31=q25 x q6=
729.
q6= 729 ; q2
=racine cubique (729) = 9 ; q = ±3.
4. Soit la
fonction définie sur R par f{x} =(2+ex)½.
a) En plus
l'infini, la limite de f(x) est :
0 ; +oo vrai ; -oo ; on ne sait
pas.
b. En plus l'infini, la limite de f(x) est :
3½ ; +oo ; -oo ; 2½ vrai.
En moins l'infini ex tend vers zéro.
5. Donnez la b0nne
réponse.
Soient ,A ef B deux éiéments tels que p(B) différe de zéro. Exprimez pB(A)
e nfonction de pA(B).
pB(A) = p(A n B) /
p(B) ; pA(B)
= p(A n B) / p(A) .
pB(A) =pA(B)p(A) /
p(B). Réponse a.
Chimie
Exercice C1 (1,5 points)
On veut préparer 10 rnL d'une solutisn S2 à une
concentration massique de 10 µg / mL à partir d'une solution S1
à
une concentration massique de 1 rng / mL
1. Quel volume de S1
doit-on mesurer ?
1 mg = 1000 µg ; facteur de dilution : 100 ; volume de S1
à mesurer 10 / 100 = 0,10 mL.
2. Quelle dilution
a t-on ef{eetué ?
Facteur de dilution : 100
3. Quelle formule permet de relier
la concentration massique Cm et la concentration motaire C d'un composé
et
définissez chaque terme supplémentaire ?
Cm = C M avec M masse molaire en g / mol.
Exercice C2 ( 1
point)
Donnez la bonne réponse.
1. L'acétonitrite
est un solvant polaire. H3C--CN. Vrai ( présence du groupe nitrile).
2. L'hexane est un
solvant polaire. Faux. (
présence d'une longue chaine carbonée H3C-(CH2)4-CH3).
Exercice C4(0,5
point)
Quel est Ie pH de l'eau de javel?
12,5 vrai ; 2,2 ; 7,4.
Exercice C5(1,5
point)
1. Un acide est:
a) un accepteur de proton
b) un donneur de proton vrai
c) un accepteur de neutron.
2. Comrnent
appelle-t-on une molécule qui peut à la fois jouer le rôle d'une base
et le rôle d'un acide ?
a) une rnolécule amphibie
b) une molécule amphotère vrai
c) une molécule réductrice.
3. Quelle est
l'équation de réaction entre l'ammoniaque et l'acide éthanoïque?
NH3 + CH3COOH --> NH4+ +
CH3COO- réponse b.
Exercice C5 (1point)
1. Une réaction
avec une perte d'électron est une :
a) Réduction ; b) Oxydation vrai
; c) Oxydo-réduction.
Un réducteur cède des électrons, il s'oxyde.
2: Cu2+(aq)
+ 2e-+ Cu (s) correspond à une :
a) Réduction vrai; b)
Oxydation ; c)Oxydo-réduction.
Cu2+aq gagne
des électrons, c'est un oxydant qui se réduit.