Chute verticale dans un fluide visqueux.
Cet exercice propose de modéliser la chute verticale d’une bille de plomb dans une huile
alimentaire.
Données : Les actions exercées par le fluide sur la bille sont modélisées par une force de
frottement fluide : f = 6
p h r v dans laquelle
h est la viscosité du fluide, r est le rayon de la
bille et v le vecteur vitesse de la bille ;
intervalle des valeurs courantes de la viscosité
h d’une huile alimentaire : entre 60 et
100 mPa·s.
Une bille de plomb de rayon r = 1,03 mm et de masse m = 0,056 g est lâchée à t = 0 s
sans vitesse initiale dans une huile alimentaire .
On nomme v(t) la valeur de la vitesse de la bille, exprimée en m·s
-1 , à l’instant t, exprimé
en seconde.
L’axe Oy est orienté suivant la verticale descendante.
Le pointage des positions successives de la bille permet de tracer l’évolution de sa vitesse
en fonction du temps :
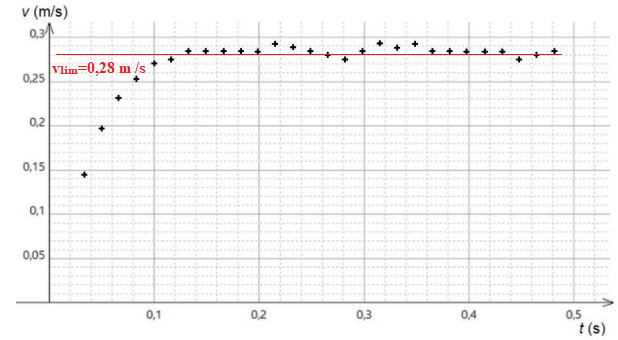 1.
1. Justifier, à partir des résultats de la figure , que la chute de la bille n’est pas une chute
libre.
Dans le cas d'une chute libre sans vitesse initiale la vitesse est uen fonction linéaire du temps : v = gt.
2. Estimer graphiquement la valeur de la vitesse de chute de la bille en régime permanent.
Vitesse limite de chute = 0,28 m /s.
Pour la suite de l’exercice, on prendra comme valeur de la viscosité de l’huile alimentaire
h = 8010
-3
Pa·s.
3. En considérant le système {bille} dans le référentiel du laboratoire supposé galiléen,
écrire l’expression vectorielle de la seconde loi de Newton.
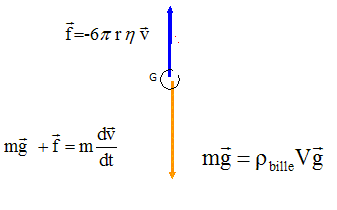 4.
4. En déduire, par projection de la deuxième loi de Newton sur l’axe (Oy), que la vitesse
de chute de la bille doit vérifier l’égalité :
dv
/dt
= -
6
phr
/m
v + g
mdv
/dt
= -
6phr
v +m g.
Diviser par m : dv
/dt
= -
6phr
/m
v + g
Étude mathématique de la vitesse.
On souhaite déterminer une expression de la vitesse de la chute de la bille. Les données
physiques de l’expérience conduisent à résoudre l’équation différentielle (E) :
y ’ = - 27,7y + 9,81.
5. Déterminer l’ensemble des solutions de l’équation différentielle (E).
Solution générale de y '+27,7 y = 0 : y = A exp(-27,7t) avec A une constante.
Solution particulière de (E) : y = 9,81 / 27,7 =0,354.
Solution générale de (E) :
y = A exp(-27,7t) +0,354.
6. Montrer que l’unique solution v de l’équation différentielle (E) qui vérifie v(0) = 0 est
définie par l’expression :
v(t) =
9,81/
27,7 (1-exp(-27,7 t)). Calculer la limite de v(t) en plus l'infini.
v(t=0) = A exp(-27,7*0) +0,354=0.
A +0,354 = 0 ; A = -0,354= -9,81 / 27,7.
v(t) =y = -9,81 /27,7 exp(-27,7t) +9,81 / 27,7.
v(t) =
9,81/
27,7 (1-exp(-27,7 t)).
En plus l'infini, le terme en exponentielle tend vers zéro et v(t) tend vers9,81 / 27,7 m /s.
Analyse du modèle obtenu.
Dans cette expérience, la valeur de la vitesse de la bille, exprimée en m·s
-1
, en fonction
du temps t exprimé en s, est donnée par la fonction v définie sur [0 ; 0,5] dont l’expression
est :
v(t) = 0,35 × (1-exp(-27,7 t)
).
8. Vérifier la cohérence de l’ordre de grandeur de la limite obtenue à la question 7 avec
celui de la vitesse en régime permanent estimée à la question 2. Proposer une justification
à l’écart observé.
Ecart relatif entre les deux valeurs :(0,35 -0,28) / 0,28 x100 =25 %.
La bille est soumise en plus des frottements à la poussée d'Archimède, verticale vers le haut.
 Le silicium dans les molécules organiques et dans les panneaux photovoltaïques
Le silicium dans les molécules organiques et dans les panneaux photovoltaïques.
Les propriétés semi-conductrices du silicium et son abondance sur Terre en font un
candidat de choix pour la fabrication des panneaux photovoltaïques.
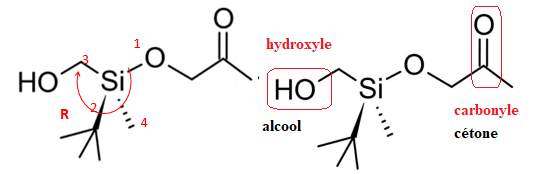
Silicium et structure spatiale de molécules
Le trichlorosilane est un intermédiaire dans la fabrication du silicium ultra-pur. Une
représentation de Cram est donnée ci-dessous.
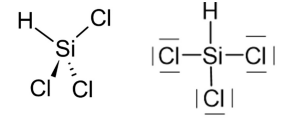 1.
1. Déterminer la géométrie autour de l’atome de silicium dans la molécule de
trichlorosilane à l’aide de la théorie VSEPR. La comparer à une géométrie courante autour
des atomes de carbone dans les molécules organiques.
Type AX
4, géométrie tétraédrique.
2. Préciser en justifiant la réponse, si la molécule de trichlorosilane est chirale.
Le silicium n'est pas lié à 4 atomes différents : la molécule n'et pas chirale.
Les molécules organiques contenant du silicium sont aussi utilisées pour synthétiser des
molécules d’intérêt biologique. La molécule ci-dessous, notée A, permet la fabrication au
laboratoire d’une phéromone naturelle.
3. Repérer deux groupes caractéristiques de la molécule, les recopier dans la copie et
donner le nom de la fonction chimique associée à chacun d’entre eux.
4. Donner la définition d’un atome de carbone asymétrique.
Carbone lié à 4 atomes ou groupe d'atomes différents.
5. Appliquer les règles de Cahn, Ingold et Prelog aux quatre groupes d’atomes portés par
l’atome de silicium dans la molécule A pour leur classement par ordre de priorité.
6. Déduire la configuration absolue de l’atome de silicium de la molécule, avec la même
méthode que celle utilisée pour un atome de carbone.
 Structure cristalline des cellules en silicium d’un panneau photovoltaïque
Structure cristalline des cellules en silicium d’un panneau photovoltaïque.
Données : dimensions de la cellule photovoltaïque : 9,7 cm x 7,6 cm.
Différents types de cellules en silicium sont utilisées pour fabriquer des panneaux
photovoltaïques :
- les cellules monocristallines (sc-Si) dont le rendement commercial des modules se situe
entre 13 et 21 %. Cette technologie est avantageuse, mais présente un coût élevé en
raison du prix des matériaux et de la quantité d'énergie requise pour leur fabrication ;
- les cellules polycristallines (mc-Si) dont le coût de fabrication est plus avantageux mais
qui présentent un rendement entre 11 et 18 % plus faible que les cellules monocristallines.
Environ 57 % des panneaux photovoltaïques vendus dans le monde se composaient de
cellules mc-Si en 2011 ;
- les cellules au silicium amorphe (a-Si) ne contenant du silicium que sur une épaisseur
d'environ 1 µm. Le caractère amorphe, c’est-à-dire désordonné des atomes de silicium
dans ces cellules entraine des rendements plus faibles, compris entre 6 et 8 %. Jusqu'en
2000, cette technologie a principalement été destinée à alimenter de petits appareils
électroniques, comme des montres ou des calculatrices.
D’après le site Futura-Sciences.
Dans le cadre de l’étude expérimentale d’un panneau photovoltaïque, on mesure la tension
U (en V) aux bornes du panneau photovoltaïque et l’intensité I (en A) du courant qu’il
délivre lorsqu’il alimente une résistance variable R branchée à ses bornes grâce au
dispositif expérimental ci-dessous :
Les mesures obtenues sont intégrées dans un programme écrit en langage Python pour
déterminer la puissance électrique délivrée, notée Pé, dans le circuit par le panneau. Une
capture d’écran d’un extrait du programme est donnée ci-après.
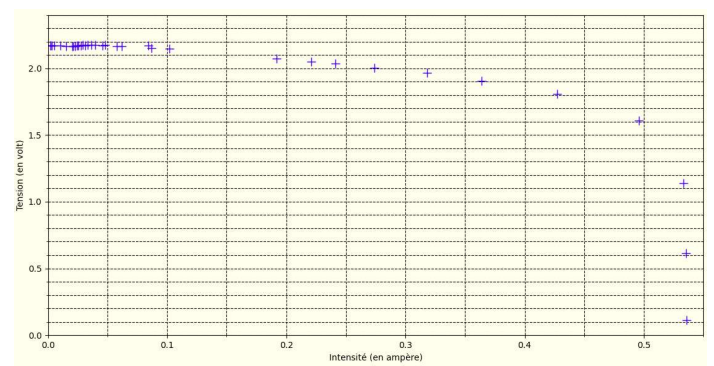
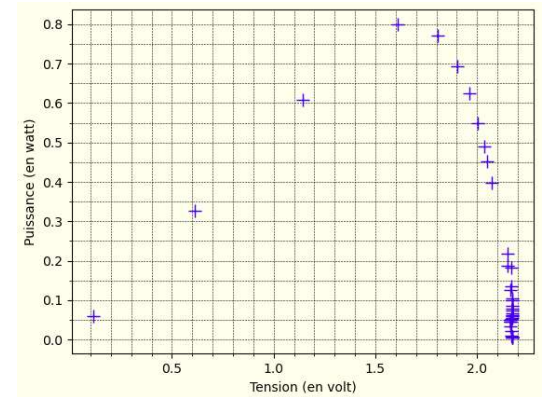
Le programme trace l’évolution de la tension U en fonction de l’intensité I puis l’évolution
de la puissance P en fonction de la tension U aux bornes du générateur.
 7.
7. Justifier que le panneau solaire n’est pas une source idéale de tension.
La tension U n'est pas constante, elle dépend de l'intensité.
8. Déterminer, parmi les valeurs mesurées de la tension U et de l’intensité I, celles pour
lesquelles la puissance délivrée par le panneau solaire est maximale.
U = 1,6 V et I = 0,5 A. P = U x I = 1,6 x0,5 = 0,8 W.
9. Recopier sur la copie la ligne de code du programme écrit en langage Python qui calcule
les valeurs successives de la puissance électrique libérée P.
P= [U*I]
10. Sachant que les mesures ont été réalisées sous un éclairement énergétique de
900 W·m
–2, déterminer la nature probable de la cellule photovoltaïque (cellule
monocristalline (sc-Si), cellule polycristalline (mc-Si) ou cellule au silicium amorphe (a-Si)).
Surface de la cellule S = 9,7 x 7,6 =73,72 cm
2 = 7,372 10
-3 m
2.
Puissance solaire reçue : 900 x
7,372 10-3 ~6,6 W.
Rendement : 0,8 / 6,6 x100 ~12 %. ( cellule polycristalline)